
【題目】碳、氮、氟、硅、銅等元素的化合物廣泛存在于自然界,回答下列問題:
(1)基態氟原子核外電子的電子云形狀有_____種;氟原子的價電子排布式為___。
(2)NF3是微電子工業中優良的等離子刻蝕氣體,NF3分子的空間構型為______;寫出與N2互為等電子體的一種離子的化學式_______。
(3)已知金剛石中的C-C鍵鍵長為154.45pm,C60中C-C鍵鍵長為145~140pm,而金剛石的熔點遠遠高于C60,其理由是________。
(4)氫基倍半硅氧烷的分子結構如圖所示,該分子的分子式為______,Si原子采用_______雜化。

(5)Cu的某種晶體晶胞為面心立方結構,晶胞邊長為acm,原子的半徑為rcm。該晶體中銅原子的堆積方式為_______(填“A1”“A2”或“A3”),該晶體的密度為______g/cm3(用含a和NA的代數式表示),該晶體中銅原子的空間利用率為______(用含a和r的代數式表達)。
【答案】2 2s22p5 三角錐形 CN-或C22-或NO+ 金剛石屬于原子晶體,熔化時需要破壞共價鍵;而C60屬于分子晶體,熔化時只需克服分子間作用力,不需要克服共價鍵。 Si8H8O12 sp3 A1 ![]()
![]()
【解析】
(1)原子核外有幾個電子,就會有幾種不同狀態的電子;s能級電子云為球形、p能級電子云為啞鈴形;F原子最外能層上的3s、3p能級上電子為其價電子;
(2)根據價層電子對互斥理論,計算NF3分子中N原子孤電子對數和價層電子對數,由所得結果判斷分子空間構型;等電子體是指原子總數相同,價電子總數也相同的微粒;
(3)金剛石和C60的晶體類型不同,金剛石為原子晶體,C60為分子晶體,熔化不同晶體所破壞的作用力不同;
(4)由分子結構可知,分子中有8個Si原子、8個H原子、12個O原子;Si原子形成4個價鍵,沒有孤電子對,雜化軌道數目為4;
(5)根據堆積方式分析,金屬Cu的堆積方式為密置層ABCABC……堆積;根據均攤法計算晶胞中Cu原子數目,即可計算晶胞質量,再由晶體密度=晶胞質量÷晶胞體積計算晶胞密度;空間利用率=![]() ×100%。
×100%。
(1)F是9號元素,基態F原子核外有9個電子,所以基態F原子核外電子有9種運動狀態;F原子3s、3p能級上電子為其價電子,價電子排布式為2s22p5;
(2)NF3分子中N原子孤電子對數=![]() ,NF3分子含有3個σ鍵,所以分子空間構型為三角錐形;等電子體是指原子總數相同,價電子總數也相同的微粒,與N2互為等電子體的一種離子的化學式CN- 或C22-或NO+;
,NF3分子含有3個σ鍵,所以分子空間構型為三角錐形;等電子體是指原子總數相同,價電子總數也相同的微粒,與N2互為等電子體的一種離子的化學式CN- 或C22-或NO+;
(3)金剛石為原子晶體,C60為分子晶體,金剛石熔化時需要破壞共價鍵,而C60熔化時只需克服分子間作用力不需要克服共價鍵;
(4)由分子結構可知,分子中有8個Si原子、8個H原子、12個O原子,故分子式為:Si8H8O12;Si原子形成4個價鍵,沒有孤電子對數,雜化軌道數目為4,Si原子采取sp3雜化;
(5)根據堆積方式分析,金屬Cu的堆積方式為密置層ABCABC……堆積,該堆積方式為面心立方最密堆積,即屬于Au堆積;晶胞中Cu原子數目=8×![]() +6×
+6×![]() =4,晶胞質量=4×
=4,晶胞質量=4×![]() g,則晶體密度ρ=
g,則晶體密度ρ=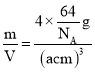 =
=![]() g/cm3;晶胞中Cu原子總體積=4×
g/cm3;晶胞中Cu原子總體積=4×![]() π(rcm)3=
π(rcm)3=![]() cm3,所以該晶體中銅原子的空間利用率為
cm3,所以該晶體中銅原子的空間利用率為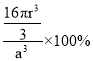 =
=![]() ×100%。
×100%。


科目:高中化學 來源: 題型:
【題目】已知化學反應A2(g)+B2(g)=2AB(g)的能量變化如圖所示,判斷下列敘述中正確的是( )
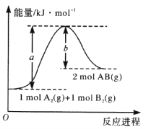
A. 每生成2 mol AB吸收bkJ熱量
B. 該反應熱△H= + (a-b)kJ mol-1
C. 該反應中反應物的總能量高于生成物的總能量
D. 斷裂1 mol A—A和1 mol B—B鍵,放出akJ能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Cl2O為國際公認的高效安全滅菌消毒劑之一,實驗室可利用氯氣和空氣(氯氣與空氣體積比為1∶3,空氣不參與反應)的混合氣與含水8%的碳酸鈉反應制備,并用水吸收Cl2O制備次氯酸溶液,所用實驗裝置和Cl2O的性質如下:
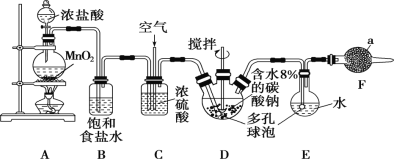
顏色 | 棕黃色 |
狀態 | 氣體 |
氣味 | 強刺激性 |
熔點 | -116 ℃ |
沸點 | 3.8 ℃ |
水溶性 | 極易溶于水,與水反應生成次氯酸 |
熱穩定性 | 42 ℃以上分解為Cl2和O2 |
(1)儀器a的名稱為________,所盛放的藥品是________。
(2)寫出裝置A中發生反應的離子方程式:_______________。
(3)裝置C的主要作用是___________。
(4)裝置D、E中都用到多孔球泡,其作用是____________。
(5)寫出裝置D中Cl2與過量碳酸鈉反應生成Cl2O的化學方程式:________。
(6)裝置E采用棕色圓底燒瓶的原因是____________。
(7)制備Cl2O裝置中存在缺陷,請提出改進措施:___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的某磁黃鐵礦(主要成分FexS,S為-2價)與100mL鹽酸恰好完全反應(礦石中其他成分不與鹽酸反應),生成3.2g硫單質、0.4molFeCl2和一定量H2S氣體,且溶液中無Fe3+。則下列說法正確的是( )
A.該鹽酸的物質的量濃度為4.0mol·L-1
B.該磁黃鐵礦FexS中,Fe2+與Fe3+的物質的量之比為2:1
C.生成的H2S氣體在標準狀況下的體積為8.96L
D.該磁黃鐵礦中FexS的x=0.85
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質中,互為同分異構體的是
A.CH3CH2CH3 和CH3CH(CH3)CH3B.CH3CH2OH 和 CH3CHO
C.CH3COOH 與 HCOOCH3D.![]() 和
和 ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙、丁四種物質中,甲、乙、丙均含有相同的某元素,它們之間具有如下轉化關系:甲![]() 乙
乙![]() 丙。下列有關物質的推斷不正確的是
丙。下列有關物質的推斷不正確的是![]()
A.若甲為![]() ,則丙可能為
,則丙可能為![]()
B.若涉及反應均為氧化還原反應,則甲可能為![]()
C.若涉及反應均為氧化還原反應,則丁可能為![]()
D.若甲為![]() 溶液,則丁可能是NaOH溶液
溶液,則丁可能是NaOH溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 表示阿伏加德羅常數,下列說法正確的是
表示阿伏加德羅常數,下列說法正確的是![]()
A.標準狀況下,等體積的水和![]() ,含有的氧原子數目為1:2
,含有的氧原子數目為1:2
B.含有![]() 個陰離子的
個陰離子的![]() 與足量水反應,轉移電子數為
與足量水反應,轉移電子數為![]()
C.向含有![]() 的溶液中通入適量氯氣,當有
的溶液中通入適量氯氣,當有![]() 個
個![]() 被氧化時,共轉移電子數為
被氧化時,共轉移電子數為![]()
D.一個NO分子質量為![]() ,一個
,一個![]() 分子質量是
分子質量是![]() ,則
,則![]() 個
個![]() 的質量為
的質量為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列實驗操作和現象所得到的結論正確的是![]()
![]()
選項 | 實驗操作 | 實驗現象 | 結論 |
A | 向足量含KSCN的 | 溶液變黃 | 還原性:Fe2+>Br- |
B | 向2mL濃度為 | 開始出現白色沉淀,后出現黃色沉淀 |
|
C | 取等質量的Al和Fe,分別與足量的稀硫酸反應 | Al產生的氫氣多 | 金屬性: |
D | 向苯酚濁液中滴加飽和 | 濁液變澄清 | 酸性:苯酚 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)“84”消毒液是一種常用的消毒劑,其有效成分是______(填化學式)。某學生用石墨作電極電解飽和氯化鈉溶液,制作了一種家用環保型消毒液發生器,如圖所示。電極c處發生反應的離子方程式依次為:2H2O+2e-=H2↑+2OH-;_____。
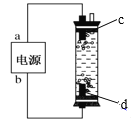
(2)“84”消毒液工業品中常含有1.5%~3%的NaOH,其目的一是使平衡_____(寫出離子方程式)向逆方向移動;二是吸收空氣中的_____(填化學式)防止消毒液失效。
(3)消毒液中氯元素的存在形態與溶液pH的關系如下:
溶液pH | >9 | 5~6 | 4~5 | 2~3 | <2 |
主要成分 | NaClO | HClO與NaClO(少量) | HClO與Cl2(少量) | HClO與Cl2 | Cl2 |
請你寫出pH降低時產生氯氣的離子方程式:_____。
(4)某同學猜測“84消毒液”(以下簡稱“84”)可以“漂白”米醋,進行了實驗1和實驗2:
編號 | 實驗操作 | 實驗現象 |
實驗1 |
滴加2滴米醋,5滴管“84” | 溶液無色,聞到刺激性氣味 |
實驗2 |
滴加2滴米醋,5滴管蒸餾水 | 溶液為淺棕色,無刺激性氣味 |
實驗2的目的是:①______;②______。
為進一步研究“84”與米醋的反應,該同學又進行了以下實驗:
編號 | 實驗操作 | 實驗現象 |
實驗3 |
逐滴加入“84”,10滴米醋 | “84”滴入后迅速產生刺激性氣味的氣體;滴加至5滴時,溶液開始褪色;滴加至21滴時,褪為淡黃色;繼續滴加不再出現明顯褪色。 |
實驗4 |
逐滴加入米醋,21滴“84” | 滴入米醋后立即褪色;當米醋滴加至10滴時,溶液較實驗3顏色更淺;當米醋加至17滴時,與實驗3中溶液最終顏色相同。 |
請你結合上述實驗和相關資料,分析實驗3與實驗4現象的差異:______。
(5)某工廠使用次氯酸鈉漂白棉布,該工廠對生產條件進行了研究,結果如圖所示:
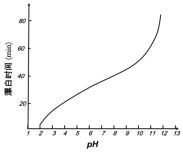
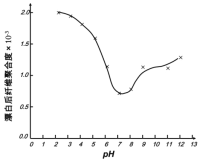
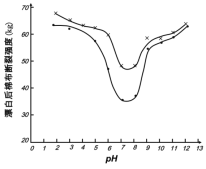
查閱資料得知:次氯酸鈉對纖維素的破壞分為兩個階段進行。第一階段:纖維素纖維的羥基與次氯酸作用生成次氯酸酯;第二階段:生成的次氯酸酯在OH-離子作用下,失去一分子氯化氫,并轉變為醛或酮,直接影響纖維素化學鍵的穩定性。
①當溶液pH=7時,纖維聚合度最低,纖維損傷最嚴重的原因是:_____。
②綜合考慮,生產過程中pH最好選擇_____,理由是_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com