
【題目】已知A、B、C、D四種短周期元素,它們的核電荷數依次增大。A原子、C原子的L能層中都有兩個未成對的電子,C、D同主族。E、F都是第4周期元素,E原子核外有4個未成對電子,F原子除最外能層只有1個電子外,其余各能層均為全充滿。根據以上信息填空:
(1)基態D原子中,電子占據的最高能層符號是________,
該能層具有的原子軌道數為________。
(2)E2+的價層電子排布圖是________,
F原子的核外電子排布式是________。
(3)A元素的最高價氧化物對應的水化物中心原子采取的軌道雜化方式為________,
B元素的氣態氫化物的分子模型為________。
(4)化合物AC2、B2C和陰離子DAB-互為等電子體,它們結構相似,DAB-的電子式為________。
(5)某種化合物由D、E、F三種元素組成,其晶胞如圖所示,則其化學式為________,該晶胞上下底面為正方形,側面與底面垂直,根據圖中所示的數據列式計算該晶體的密度:d=________g·cm-3。

【答案】(1)M 9 (2)![]() 1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s1
(3)sp2 三角錐形 (4) ![]()
(5)CuFeS2 [![]() ×4]÷[(524×10-10cm)2×(1 030×10-10)cm]=4.32
×4]÷[(524×10-10cm)2×(1 030×10-10)cm]=4.32
【解析】A、B、C、D四種短周期元素,它們的核電荷數依次增大,A原子、C原子的L能層中都有兩個未成對的電子,則A原子核外電子排布式為1s22s22p2, C原子核外電子排布式為1s22s22p4,故A為碳元素、C為氧元素;B原子序數介于C、O之間,則B為氮元素;C、D同主族,則D為硫元素;E、F都是第4周期元素,E原子核外有4個未成對電子,原子核外電子排布式為1s22s22p63s23p63d64s2,則E為Fe;F原子除最外能層只有1個電子外,其余各能層均為全充滿,F原子核外電子數=2+8+18+1=29,則F為銅元素。
(1)基態硫原子中電子占據的最高能層為第3能層,符號為M,該能層有1個s軌道、3個p軌道、5個d軌道,共有9個原子軌道。
(2)Fe2+的價層電子排布式為3d6,其價層電子排布圖是![]() ,F為銅元素,原子核外有29個電子,原子的核外電子排布式是1s22s22p63s23p63d104s1。
,F為銅元素,原子核外有29個電子,原子的核外電子排布式是1s22s22p63s23p63d104s1。
(3)碳元素的最高價氧化物對應的水化物為H2CO3,分子結構式為![]() ,中心碳原子成3個σ鍵、沒有孤電子對,碳原子采取sp2雜化方式;B的氣態氫化物為NH3,為三角錐形結構。
,中心碳原子成3個σ鍵、沒有孤電子對,碳原子采取sp2雜化方式;B的氣態氫化物為NH3,為三角錐形結構。
(4)化合物CO2、N2O和陰離子SCN-互為等電子體,它們結構相似,SCN-中碳原子與硫、氮原子之間分別形成2對共用電子對,SCN-的電子式為![]()
(5)晶胞中D(S)原子位于晶胞內部,原子數目為8個,E(Fe)原子6個位于面上、4個位于棱上,E(Fe)原子數目=6×![]() +4×
+4×![]() =4,F(Cu)原子4個位于面上、1個位于內部、8個位于頂點上,原子數目=4×
=4,F(Cu)原子4個位于面上、1個位于內部、8個位于頂點上,原子數目=4×![]() +1+8×
+1+8×![]() =4,晶體中銅、鐵、硫原子數目之比=4∶4∶8=1∶1∶2,故該晶體化學式為CuFeS2;晶胞質量=
=4,晶體中銅、鐵、硫原子數目之比=4∶4∶8=1∶1∶2,故該晶體化學式為CuFeS2;晶胞質量=![]() ×4,晶胞體積=(524×10-10cm)2×(1 030×10-10)cm,該晶體的密度d=
×4,晶胞體積=(524×10-10cm)2×(1 030×10-10)cm,該晶體的密度d=
[![]() ×4]÷[(524×10-10cm)2×(1 030×10-10)cm]=4.32 g·cm-3。
×4]÷[(524×10-10cm)2×(1 030×10-10)cm]=4.32 g·cm-3。


科目:高中化學 來源: 題型:
【題目】描述弱電解質電離情況可以用電離度和電離平衡常數表示,下表是常溫下幾種弱電解質的電離平衡常數:
酸或堿 | 電離常數(Ka或Kb) | 難(微)溶物 | 溶度積常數(Ksp) |
CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
HCN | 5×10-10 | CaSO4 | 7×10-5 |
HClO | 3×10-8 | CaCO3 | 5×10-9 |
NH3·H2O | 1.8×10-5 |
請回答下面問題:
(1)上述四種酸中,酸性最弱的是_____________ (用化學式表示)。下列能使醋酸溶液中CH3COOH的電離程度增大,而電離常數不變的操作是________________(填序號)。
A.升高溫度 B.加水稀釋
C.加少量的CH3COONa固體 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________ (選填“酸性”“中性”或“堿性”),理由是__________________,溶液中各離子濃度大小的關系是_____________________。
(3)物質的量1∶1的NaCN和HCN的混合溶液,其pH>7,該溶液中離子的濃度從大到小排列為_____________________________________。
(4)工業中常將BaSO4轉化為BaCO3后,再將其制成各種可溶性的鋇鹽(如:BaCl2)。具體做法是用飽和的純堿溶液浸泡BaSO4粉末,并不斷補充純堿,最后BaSO4轉化為BaCO3。現有足量的BaSO4懸濁液,在該懸濁液中加純堿粉末并不斷攪拌,為使SO42-物質的量濃度達到0.0lmol·L-1以上,則溶液中CO32-物質的量濃度應 ≥____________mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】美國NASA曾開發一種鐵—空氣二次電池。該電池放電時,其原理如下圖所示,電池反應為:2Fe+O2+2H2O===2Fe(OH)2。
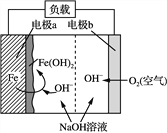
有關該電池放電時的說法正確的是( )
A. a極質量不變
B. b極為電池負極
C. 電子由a極經負載流向b極
D. 由電能轉變為化學能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的說法正確的是
A. 乙醇的結構簡式為C2H6O B. C4H2C18有5種同分異構體
C. 乙酸可以電離,屬于離子化合物 D. 苯乙烯分子中所有原子可能共平面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】欲檢驗CO2氣體中是否含有SO2、HCl,進行如下實驗:
①將氣體通入酸化的AgNO3溶液中,產生白色沉淀a;
②濾去沉淀a,向濾液中加入Ba(NO3)2溶液,產生白色沉淀b.
下列說法正確的是( )
A.沉淀a為AgCl
B.沉淀b為BaCO3
C.氣體中含有SO2
D.氣體中沒有HCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋資源的利用具有廣闊前景。
(1)下圖是從海水中提取鎂的簡單流程:
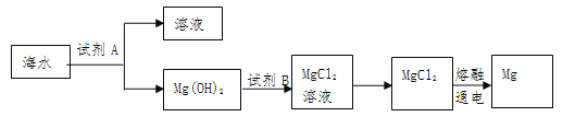
①Mg(OH)2轉化為MgCl2的離子方程式是_______________,
②將MgCl2溶液在________氣流中蒸發、冷卻、結晶制得MgCl2晶體。
③由無水MgCl2制取Mg的化學方程式是________________________。
(2)海帶灰中富含以I-形式存在的碘元素。實驗室提取I2的途徑如下所示:

①灼燒海帶至灰燼時所用的主要儀器名稱是________________。
②向酸化的濾液中加過氧化氫溶液,寫出該反應的離子方程式:_____________________。
③反應結束后,可加入_________作萃取劑,采用萃取-分液的方法從碘水中提取碘。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒溫時,向1L固定容積的容器中充入0.1mol NO2,發生反應2NO2(g)![]() N2O4(g),下列敘述能說明該反應達到平衡狀態的是
N2O4(g),下列敘述能說明該反應達到平衡狀態的是
A. V(NO2)=2V(N2O4) B. 容器內的壓強不變時
C. 容器中c(NO2)=c(N2O4)時 D. 容器中氣體的總質量保持不變時
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com