
【題目】下圖是部分短周期元素化合價與原子序數的關系圖,下列說法正確的是
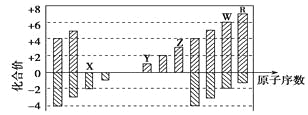
A. 原子半徑:Z>Y>X
B. 氣態氫化物的穩定性:R<W
C. WX3和水反應形成的化合物是離子化合物
D. Y和Z兩者最高價氧化物對應的水化物能相互反應
【答案】D
【解析】試題分析:根據短周期元素原子序數與化合價的關系可知,X的主要化合價是-2價,因此X是氧元素。Y的主要化合價是+1價,且原子序數大于氧元素的原子序數,則Y是Na元素。以此類推Z是Al元素、W是S元素、R是氯元素。A、同周期自左向右原子半徑逐漸減小,同主族自上而下原子半徑逐漸增大,所以原子半徑:Y>Z>X,A不正確;B、同周期自左向右非金屬性逐漸減弱,氫化物的穩定性逐漸減弱,所以氣態氫化物的穩定性:R>W,B不正確;C、三氧化硫與水反應生成硫酸,硫酸是由共價鍵形成的共價化合物,C不正確;D、由于氫氧化鋁是兩性氫氧化物,能溶解在氫氧化鈉溶液中生成偏鋁酸鈉和水,D正確,答案選D。


科目:高中化學 來源: 題型:
【題目】I..已知拆開或形成1 mol化學鍵所吸收或放出的能量叫做該化學鍵的鍵能,單位kJ·mol-1。白磷在氧氣中燃燒的化學方程式可用結構式表示為如圖所示:
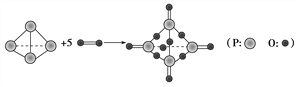
試根據下表中的化學鍵鍵能計算0.1molP4(白磷)在氧氣中充分燃燒放出能量為________kJ
化學鍵 | P—P | P—O | O===O | P===O |
鍵能/kJ·mol-1 | 198 | 360 | 498 | 585 |
II.將V1 mL 2.0 mol·L-1 HCl溶液和V2 mL未知濃度的NaOH溶液混合均勻后測量并記錄溶
液溫度,實驗結果如下圖所示(實驗中始終保持V1+V2=50 mL)。請按要求填空:

(1)該實驗表明此反應_______(填“吸收”或“釋放”)能量, 通過圖示分析可以得出:做該實
驗時,環境溫度________(填“高于”、“低于”或“等于”)22 ℃。
(2)根據圖示計算該NaOH溶液的濃度約是________mol·L-1。
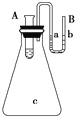
III. 如圖所示在錐形瓶放置有裝有水的小試管,往小試管中分別加入下列物質時:①燒堿固體
②濃硫酸 ③硝酸銨固體 ④NaCl固體,其中能使a端液面高于b端液面的是_____(填序號)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】安全氣囊是行車安全的重要設施。當車輛發生碰撞的瞬間,安全裝置通電點火使其中的粉末分解釋放出大量的氮氣形成氣囊,從而保護司機及乘客。為研究安全氣囊工作的化學原理,取安全裝置中的粉末進行研究。經實驗分析,確定該粉末是一種混合物且只含Na、Fe、N、O四種元素。
(1)氧元素在元素周期表中的位置是__________________,Na原子結構示意圖為_____________,其中三種主族元素的離子半徑從大到小的順序是___________________(用離子符號表示)。
(2)氮的最高價氧化物對應的水化物與其氫化物反應生成一種鹽,該鹽晶體中含有的化學鍵類型是____________________。
(3)水溶性實驗表明,安全氣囊中固體粉末部分溶解,不溶物為一種紅棕色固體,可溶于鹽酸,寫出反應的化學方程式_______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列幾種粒子的結構示意圖,回答問題:
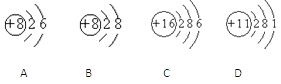
(1)屬于陰離子的是______(填粒子代號,下同)
(2)屬于金屬元素的是_______________________
(3)具有相似化學性質的是____________________
(4)D2C2含有的化學鍵類型有___________________(選填“離子鍵”“極性鍵”“非極性鍵”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于物質的類別的說法不正確的是
A.能在水溶液中或熔融狀態下導電的化合物就是電解質
B.膠體是一種能產生丁達爾效應的分散系
C.純堿不屬于堿,干冰屬于酸性氧化物
D.Na2O和Na2O2都能與水反應生成對應的堿,它們都是堿性氧化物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯仿(CHCl3,非電解質)在空氣中能發生緩慢氧化,生成劇毒物質光氣(COCl2,非電解質),化學方程式為2CHCl3+ O2="=" 2COCl2+ 2HCl。檢驗氯仿是否被氧化應選用的試劑是
A. 水 B. 硝酸酸化的硝酸銀溶液
C. 酚酞溶液 D. 氫氧化鈉溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著世界工業經濟的發展、人口的劇增,全球能源緊張及世界氣候面臨越來越嚴重的問題,如何降低大氣中CO2的含量及有效地開發利用CO2引起了全世界的普遍重視。
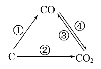
(1)如圖為C及其氧化物的變化關系圖,若①變化是置換反應,則其化學方程式可為;
(2)把煤作為燃料可通過下列兩種途徑:
途徑Ⅰ:C(s)+O2(g)===CO2(g)ΔH1<0;①
途徑Ⅱ:先制成水煤氣:C(s)+H2O(g)===CO(g)+H2(g)ΔH2>0;②
再燃燒水煤氣:2CO(g)+O2(g)===2CO2(g)ΔH3<0,③
2H2(g)+O2(g)===2H2O(g)ΔH4<0。④
則途徑Ⅰ放出的熱量________(填“大于”、“等于”或“小于”)途徑Ⅱ放出的熱量。
(3)甲醇是一種可再生能源,具有開發和應用的廣闊前景,已知反應2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某溫度下的平衡常數為400。此溫度下,在密閉容器中加入CH3OH,反應到某時刻測得各組分的濃度如下:
CH3OCH3(g)+H2O(g)某溫度下的平衡常數為400。此溫度下,在密閉容器中加入CH3OH,反應到某時刻測得各組分的濃度如下:
物質 | CH3OH | CH3OCH3 | H2O |
濃度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
比較此時正、逆反應速率的大小:v正____v逆(填“>”“<”或“=”)。
(4)生產液晶顯示器的過程中使用的化學清洗劑NF3是一種溫室氣體,其存儲能量的能力是CO2的12000~20000倍,在大氣中的壽命可長達740年之久,以下是幾種化學鍵的鍵能:
化學鍵 | N≡N | F—F | N—F |
鍵能/kJ·mol-1 | 941.7 | 154.8 | 283.0 |
則反應N2(g)+3F2(g)═2NF3(g)的ΔH=
(5)25℃、101kPa時,已知:
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
則△H3與△H1和△H2間的關系正確的是
A.△H3=△H1+2△H2B.△H3=△H1+△H2
C.△H3=△H1﹣2△H2D.△H3=△H1﹣△H2
(6)臭氧可用于凈化空氣,飲用水消毒,處理工業廢物和作為漂白劑。臭氧幾乎可與除鉑、金、銥、氟以外的所有單質反應。如6Ag(s)+O3(g)=3Ag2O(s)ΔH=-235.8kJ·mol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2kJ·mol-1,
則O3轉化為O2的熱化學方程式為。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】采用硫鐵礦焙燒取硫后的燒渣(主要成分為Fe2O3、SiO2、Al2O3,不考慮其他雜質) 制取綠礬(FeSO4·7H2O),某學習小組設計了如下流程:

下列說法錯誤的是
A. 酸浸時選用足量硫酸,試劑X為鐵粉
B. 濾渣a主要含SiO2,濾渣b主要含Al(OH)3
C. 從濾液B得到綠礬產品的過程中,必須控制條件防止其氧化和分解
D. 試劑X若為過量NaOH溶液,得到的沉淀用硫酸溶解,再結晶分離也可得綠礬
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com