
【題目】(1)從氧化還原的角度分析水在下列化學反應中的作用(從氧化劑、還原劑角度分析)。
①電解水:_____________________________________________________。
②鈉和水的反應(2Na+2H2O=2NaOH+H2↑):_______________________________。
③氟氣和水反應(2F2+2H2O=4HF+O2):_______________________________。
④氯氣和水反應(Cl2+H2O=HCl+HClO):______________________________。
(2)某一反應體系中有反應物和生成物共5種物質:S、H2S、HNO3、NO、H2O。該反應體系中還原產物是________;若反應中轉移了0.3 mol電子,則氧化產物的質量是________g。
(3)將少量Cl2通入FeBr2的溶液中,反應的離子方程式為2Fe2++Cl2=2Fe3++2Cl,這個事實說明具有還原性的粒子還原性強弱順序為____________。足量Cl2通入FeBr2溶液中發生反應的離子方程式為________________。
【答案】既作氧化劑,又作還原劑作氧化劑作還原劑既不作氧化劑,也不作還原劑NO4.8Fe2+>Br>Cl2Fe2++4Br+3Cl2![]() 2Fe3++2Br2+6Cl
2Fe3++2Br2+6Cl
【解析】
(1)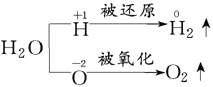
所以在反應①中H2O既作氧化劑又作還原劑,在反應②中水只作氧化劑,在反應③中H2O只作還原劑,在反應④中H2O既不作氧化劑也不作還原劑。
(2)由于HNO3具有強氧化性,H2S具有還原性,此反應為HNO3將H2S氧化成S,自身被還原為NO,其中![]() ,轉移2 mol e-時生成32 gS,當轉移0.3 mol電子時,得到S的質量為4.8 g。
,轉移2 mol e-時生成32 gS,當轉移0.3 mol電子時,得到S的質量為4.8 g。
(3)Fe2+、Br-均具有還原性,當通入少量Cl2時只有Fe2+被氧化,說明還原性Fe2+>Br->Cl-,當通入足量Cl2時,Fe2+和Br-將按1∶2完全被氧化,離子方程式為2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-。


科目:高中化學 來源: 題型:
【題目】科研人員設想用如圖所示裝置生產硫酸,下列說法正確的是( )
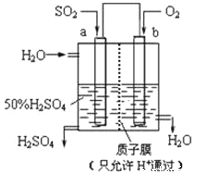
A. a為正極,b為負極
B. 生產過程中a電極質量減輕
C. 電子從b極向a極移動
D. 負極反應式為:SO2+2H2O﹣2e﹣=SO42﹣+4H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實所對應的離子方程式正確的是四氯化鈦的濃溶液制備水合二氧化鈦
選項 | 事實 | 離子方程式 |
A | 四氯化鈦的濃溶液制備水合二氧化鈦 | Ti4++(X+2)H2O |
B | 硫代硫酸鈉溶液中滴加鹽酸有淡黃色沉淀產生 | S2O32-+6H+ =2S↓+3H2O |
C | 碳酸鈉溶液顯堿性 | 2CO32- +H3O+ |
D | 碘化亞鐵溶液中滴加少量溴水,溶液變為黃色 | 2Fe2++Br2=2Fe3++2Br- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】—定溫度下,在三個等體積的恒容密閉容器中,反應2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)達平衡,下列說法不正確的是( )
C2H5OH(g)+3H2O(g)達平衡,下列說法不正確的是( )
容器 | 溫度/K | 物質的起始濃度(mol/L) | 物質的平衡濃度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 該反應正反應為放熱反應
B. 達平衡時,甲、乙容器內:2c(CO2,甲)>c(CO2,乙)
C. 達平衡時,容器甲中的逆反應速率比容器乙中的大
D. 達平衡時,轉化率:a(CO2,甲)+a(C2H5OH,丙)>1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將Na2O2投入到FeCl3溶液中,對可觀察到的現象描述較準確的是( )
A.生成白色沉淀B.生成紅褐色沉淀、有氣體
C.有氣泡產生D.生成紅褐色沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是25 ℃時某些弱酸的電離平衡常數。
化學式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4與含等物質的量的KOH的溶液反應后所得溶液呈酸性,該溶液中各離子濃度由大到小的順序為__________。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物質的量濃度的大小關系是CH3COOK________NaClO,兩溶液中:[c(Na+)-c(ClO-)]________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(3)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此時溶液pH=________。
(4)取10 mLpH=2的CH3COOH溶液,加入少量無水醋酸鈉固體(假設加入固體前后溶液體積保持不變),待固體溶解后,溶液中![]() 的比值將________(填“增大”“減小”或“無法確定”)。
的比值將________(填“增大”“減小”或“無法確定”)。
(5)向碳酸鈉溶液中滴加少量氯水的離子方程式為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】若用腸液(含有蛋白質水解酶)處理果蠅唾液腺的巨大染色體,得到一連續的極細長的纖絲,此纖絲可能是
A. 染色質絲 B. 多肽鏈 C. DNA分子 D. 氨基酸和核苷酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素A、B、C、D、E、F的原子序數逐漸增大,A和B同周期,A和F同族,A原子最外層電子數是內層電子數的二倍,B元素族序數是周期數的三倍,B的簡單陰離子與C、D、E的簡單陽離子電子層結構相同。請回答下列有關問題:
(1)F在元素周期表中的位置是_____________。
(2)C2B2的電子式是_________;AB2的結構式是_______。
(3)B、C、D、E離子半徑由大到小的順序為______(用離子符號回答); C、D、E最高價氧化物對應水化物的堿性由強到弱的順序為____________(用化學式表示,且用“>”符號連接回答)。
(4) C、E最高價氧化物對應水化物能夠相互反應,則反應的離子方程式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,三種碳酸鹽MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲線如圖所示。已知:pM=-lgc(M),p(CO32-)=-lgc(CO32-)。下列說法正確的是( )
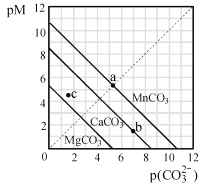
A. MgCO3、CaCO3、MnCO3的Ksp依次增大
B. a點可表示MnCO3的飽和溶液,且c(Mn2+)=c(CO32-)
C. b點可表示CaCO3的飽和溶液,且c(Ca2+)<c(CO32-)
D. c點可表示MgCO3的不飽和溶液,且c(Mg2+)>c(CO32-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com