
【題目】由碳、氫、氧3種元素組成的有機物A,相對分子質量為152,其分子中C、H原子個數比為1∶1,氧元素的質量分數為31.58%。A遇FeCl3溶液顯紫色,A能與NaHCO3溶液反應,其苯環上的一氯取代物有兩種,請回答下列問題:
(1)A的分子式是_______________________________。
(2)A的結構簡式為________________________________________。
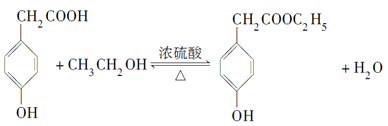
(3)A可以發生如圖所示轉化關系,D的分子式為C10H12O3,A與C反應的化學方程式________。

(4)甲、乙兩裝置均可用作實驗室由C制取B的裝置,乙圖采用甘油浴加熱(甘油沸點290 ℃,熔點18.17 ℃),當甘油溫度達到反應溫度時,將盛有C和濃硫酸混合液的燒瓶放入甘油中,很快達到反應溫度。甲、乙兩裝置相比較,乙裝置有哪些優點________________________。

【答案】 C8H8O3 ![]()
 有利于控制溫度,受熱均勻;減少副反應的發生
有利于控制溫度,受熱均勻;減少副反應的發生
【解析】分析:由碳、氫、氧3種元素組成的有機物A,相對分子質量為152,其分子中C、H原子個數比為1∶1,氧元素的質量分數為31.58%,則分子中含有的氧原子個數是![]() ,因此含有的碳氫原子數為
,因此含有的碳氫原子數為![]() 。A遇FeCl3溶液顯紫色,含有酚羥基,A能與NaHCO3溶液反應,含有羧基,其苯環上的一氯取代物有兩種,說明取代基處于對位,據此解答。
。A遇FeCl3溶液顯紫色,含有酚羥基,A能與NaHCO3溶液反應,含有羧基,其苯環上的一氯取代物有兩種,說明取代基處于對位,據此解答。
詳解:(1)根據以上分析可知A的分子式是C8H8O3。
(2)A遇FeCl3溶液顯紫色,含有酚羥基,A能與NaHCO3溶液反應,含有羧基,其苯環上的一氯取代物有兩種,說明含有2個取代基,且取代基處于對位,則A的結構簡式為![]() 。
。
(3)A與C發生酯化反應生成D,則根據A與D的分子式可知C是乙醇,所以A與C反應的化學方程式為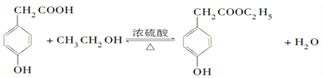 。
。
(4)乙醇在濃硫酸的作用下加熱到170℃發生消去反應制備乙烯,甲、乙兩裝置相比較,乙裝置由于采用甘油浴加熱,因此其優點為有利于控制溫度,受熱均勻,且減少副反應的發生。


科目:高中化學 來源: 題型:
【題目】法國化學家伊夫·肖萬獲2005年諾貝爾化學獎。他發現了烯烴里的碳碳雙鍵會被拆散、重組,形成新分子,這種過程被命名為烯烴復分解反應(該過程可發生在不同烯烴分子間,也可發生在同種烯烴分子間)。
如: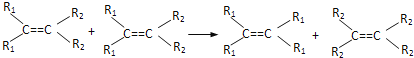
則對于有機物![]() 發生烯烴的復分解反應時,不可能生成的產物是( )
發生烯烴的復分解反應時,不可能生成的產物是( )
A. ![]() B.
B. ![]() C. CH2= CHCH3 D.
C. CH2= CHCH3 D. ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某試液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干種離子,離子濃度均為 0.1molL﹣1.某同學進行了如下實驗:

下列說法正確的是( )
A. 無法確定原試液中是否含有 Al3+、 Cl﹣
B. 濾液 X 中大量存在的陽離子有 NH4+、 Fe2+和 Ba2+
C. 無法確定沉淀 C 的成分
D. 原溶液中存在的離子為 NH4+、 Fe2+、 Cl﹣、 SO42﹣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】旨在限制發達國家溫室氣體排放量、抑制全球范圍內氣候持續變暖的《京都議定書》隨著俄羅斯的加入,將于2005年2月16日正式生效。我國二氧化碳的排放量位居世界第二,為減少二氧化碳這種溫室氣體的排放,下列措施不切實際的是
A.大力開發氫能源B.充分利用太陽能
C.不使用含碳能源D.提高能源利用率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用如下裝置制取氯氣,并用氯氣進行實驗。回答下列問題:

(1)A中盛有濃鹽酸,B中盛有MnO2,寫出反應的化學方程式_____________。
(2)D中放入濃H2SO4,其目的是_____________________________。
(3)E中為紅色干布條,F中為紅色濕布條,可觀察到的現象是___________,對比E和F中現象的差異可得出的結論及解釋是________________________________。
(4)G處的現象是____________________________________。
(5)畫出H處尾氣吸收裝置圖并注明試劑____________。
(6)家庭中常用消毒液(主要成分NaClO)與潔廁靈(主要成分鹽酸)清潔衛生。某品牌消毒液包裝上說明如下圖。

①“與潔廁靈同時使用”會產生有毒的氯氣,寫出反應的離子方程式__________。
②需“密閉保存”的原因____________________________________________。
(7)現在有一種名為“凈水丸”的產品也能對飲用水進行快速的殺菌消毒,藥丸通常分內外兩層。外層的優氯凈Cl2Na(NCO)3先與水反應,生成次氯酸起殺菌消毒作用;幾分鐘后,內層的亞硫酸鈉(Na2SO3)溶出,可將水中的余氯(次氯酸等)除去。亞硫酸鈉將水中多余次氯酸除去的離子反應方程式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用圖示裝置制備KClO溶液,再與KOH、Fe(NO3)3溶液反應制備高效凈水劑K2FeO4。

<查閱資料>Cl2與KOH溶液在20℃以下反應生成KClO,在較高溫度下則生成KClO3;
K2FeO4易溶于水,微溶于濃KOH溶液,在0℃~5℃的強堿性溶液中較穩定。
(1)儀器a的名稱:__________;裝置C中三頸瓶置于冰水浴中的目的是_____________。
(2)裝置B吸收的氣體是__________,裝置D的作用是___________________________。
(3)C中得到足量KClO后,將三頸瓶上的導管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反應溫度為25℃,攪拌1.5 h,溶液變為紫紅色(含K2FeO4),該反應的離子方程式為________________________。再加入飽和KOH溶液,析出紫黑色晶體,過濾,得到K2FeO4粗產品。
(4)K2FeO4粗產品含有Fe(OH)3、KCl等雜質,其提純步驟為:
①將一定量的K2FeO4粗產品溶于冷的3 mol/L KOH溶液中。
②過濾。
③________________________________________________________。(補充完整)
④攪拌、靜置、過濾,用乙醇洗滌2~3次。
⑤在真空干燥箱中干燥。
(5)稱取提純后的K2FeO4樣品0.2200 g于燒杯中,加入強堿性亞鉻酸鹽溶液,反應后再加稀硫酸調節溶液呈強酸性,配成250 mL溶液,取出25.00 mL放入錐形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至終點,重復操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反應為:Cr(OH)4-+FeO42- = Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+![]() Cr2O72-+H2O,Cr2O72-+6Fe2++14H+ = 6Fe3++2Cr3++7H2O,則該K2FeO4樣品的純度為____________。
Cr2O72-+H2O,Cr2O72-+6Fe2++14H+ = 6Fe3++2Cr3++7H2O,則該K2FeO4樣品的純度為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用電子式表示下列離子化合物的形成過程:
BaCl2_____________________________;
NaF__________________________________;
MgS________________________________;
K2O_________________________________。
(學法題)請歸納物質電子式的書寫及用電子式表示化合物的形成過程應注意哪些問題(至少兩點)_______、__________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化鈣微溶于水,溶于酸,可作分析試劑、醫用防腐劑、消毒劑。以下是一種制備過氧化鈣的實驗方法。回答下列問題:
(一)碳酸鈣的制備

(1)步驟①加入氨水的目的是_______。小火煮沸的作用是使沉淀顆粒長大,有利于____。
(2)下圖是某學生的過濾操作示意圖,其操作不規范的是______(填標號)。

a.漏斗末端頸尖未緊靠燒杯壁
b.玻璃棒用作引流
c.將濾紙濕潤,使其緊貼漏斗壁
d.濾紙邊緣高出漏斗
e.用玻璃棒在漏斗中輕輕攪動以加快過濾速度
(二)過氧化鈣的制備

(3)步驟②的具體操作為逐滴加入稀鹽酸,至溶液中尚存有少量固體,此時溶液呈____性(填“酸”、“堿”或“中”)。將溶液煮沸,趁熱過濾。將溶液煮沸的作用是___________。
(4)步驟③中反應的化學方程式為________,該反應需要在冰浴下進行,原因是_________。
(5)將過濾得到的白色結晶依次使用蒸餾水、乙醇洗滌,使用乙醇洗滌的目的是_______。
(6)制備過氧化鈣的另一種方法是:將石灰石煅燒后,直接加入雙氧水反應,過濾后可得到過氧化鈣產品。該工藝方法的優點是______,產品的缺點是_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com