(15分)
實驗室通過實驗測定NaOH溶液和鹽酸反應的中和熱.實驗需用約450mL 0.50mol/L NaOH溶液.容量瓶(100mL,250mL,500mL各一個)
(1)配制0.50 mol/L NaOH溶液:將NaOH固體放在
(填實驗用品或儀器的名稱),用托盤天平
g NaOH固體.在使用容量瓶前必須進行的操作是
.
(2)下列操作會使所配溶液的濃度偏高的是(填序號)
.
A.燒杯、玻璃棒沒有洗滌
B.轉移時有溶液濺出容量瓶外
C.定容時,將容量瓶上、下顛倒搖勻后發現液面低于刻度線再加水
D.容量瓶用蒸餾水洗滌后再用相同溶質的溶液潤洗
E.定容時俯視容量瓶刻度線.
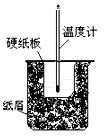
(3)將50mL 0.50mol/L鹽酸與60mL 0.50mol/L NaOH溶液在圖所示的裝置中進行中和反應.從實驗裝置上看,圖中尚缺少的一種玻璃儀器是
.
(4)一定量的稀鹽酸和過量的NaOH溶液反應,當生成1mol H
2O時放出的熱量為57.3 kJ,則該反應的熱化學方程式為
.
已知:① HCl(aq)+NH
3·H
2O(aq)=NH
4Cl(aq)+H
2O(l);△H=-a kJ·mol
-1② HCl(aq)+NaOH(s)=NaCl(aq)+H
2O(l);△H=-b kJ·mol
-1③ HNO
3(aq)+KOH(aq)=NaNO
3(aq)+H
2O(l);△H=-c kJ·mol
-1則a、b、c三者的大小關系為
(填字母).
A.a>b>c B.b>c>a C.a="b=c " D.無法比較
