
 =-41.8KJ/mol;
=-41.8KJ/mol;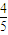 a,故平衡常數為=
a,故平衡常數為=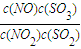 =
=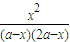 =
= ;
; .
.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
| 8 |
| 3 |
| 8 |
| 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 (1)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1;
(1)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1;查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 | 2 |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年河北省保定市高三12月月考化學試卷(解析版) 題型:選擇題
(1)已知:① TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
②2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
寫出TiO2和焦炭、氯氣反應生成液態TiCl4和CO氣體的熱化學方程式:________________。
(2)有一類甲醇質子交換膜燃料電池,需將甲醇蒸氣轉化為氫氣,兩種反應原理是:
A.CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
B.CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-676.7 kJ·mol-1
由上述方程式可知,CH3OH的標準燃燒熱________(填“大于”“等于”“小于”或“不能確定”)-676.7 kJ·mol-1。已知水的氣化熱為44 kJ·mol-1,則氫氣燃燒的熱化學方程式為__________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com