
【題目】下列化合物中,既顯酸性,又能發生酯化反應和消去反應的是( )
A.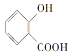
B.CH3CH=CHCOOH
C.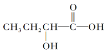
D.![]()
【答案】C
【解析】
A. 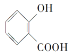 分子中含有-COOH具有酸性,含有-COOH及-OH,能夠發生酯化反應;由于羥基、羧基連接在苯環上,具有特殊的穩定性,不能發生消去反應,A不符合題意;
分子中含有-COOH具有酸性,含有-COOH及-OH,能夠發生酯化反應;由于羥基、羧基連接在苯環上,具有特殊的穩定性,不能發生消去反應,A不符合題意;
B. CH3CH=CHCOOH含有羧基-COOH,具有酸性,能夠發生酯化反應,但不能發生消去反應,B不符合題意;
C. 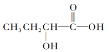 含有羧基,具有酸性;含有羧基和醇羥基,能夠發生酯化反應;由于羥基連接的C原子的鄰位C原子上含有H原子,所以可以發生消去反應,C符合題意;
含有羧基,具有酸性;含有羧基和醇羥基,能夠發生酯化反應;由于羥基連接的C原子的鄰位C原子上含有H原子,所以可以發生消去反應,C符合題意;
D. ![]() 含有醇羥基,能夠發生酯化反應,由于羥基連接的C原子的鄰位C原子上含有H原子,所以可以發生消去反應,但無羧基,因此沒有酸性,D不符合題意;
含有醇羥基,能夠發生酯化反應,由于羥基連接的C原子的鄰位C原子上含有H原子,所以可以發生消去反應,但無羧基,因此沒有酸性,D不符合題意;
故合理選項是C。


科目:高中化學 來源: 題型:
【題目】設NA為阿伏伽德羅常數的值。下列說法正確的是
A.標準狀況下,0.1mol Cl2溶于水,轉移的電子數目為0.1NA
B.標準狀況下,2.24L NO和2.24L O2混合后氣體分子數為0.15 NA
C.0.1mol Na2O2與足量的潮濕的二氧化碳反應轉移的電子數為0.1NA
D.加熱條件下,1mol Fe投入足量的濃硫酸中,生成NA個SO2分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物C常用于食品行業。已知9.0gC在足量O2中充分燃燒,將生成的混合氣體依次通過足量的濃硫酸和堿石灰,分別增重5.4g和13.2g,經檢驗剩余氣體為O2。
(1)C分子的質譜圖如圖所示,從圖中可知其相對分子質量是__,則C的分子式是__。
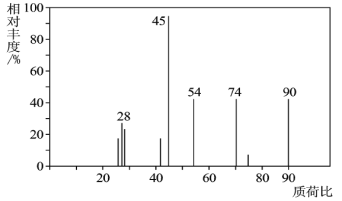
(2)C能與NaHCO3溶液發生反應,C一定含有的官能團是__。
(3)C分子的核磁共振氫譜有4個峰,峰面積之比是1:1:1:3,則C的結構簡式是__。
(4)0.1molC與1.0mol/L的氫氧化鈉溶液反應,需溶液的體積是__mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子反應方程式書寫正確的是
A.往稀鹽酸中逐滴加入Na2CO3溶液,開始時:H++CO32-=HCO3-
B.草酸(H2C2O4)溶液中加入酸性KMnO4溶液:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
C.往少量澄清石灰水中加入Ca(HCO3)2溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.用HI溶液溶解Fe2O3固體:Fe2O3+6H+=2Fe3++3H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】機動車排放的污染物主要有碳氫化合物、一氧化碳和氮氧化物等。
I.汽油燃油車上安裝三元催化轉化器,可有效降低汽車尾氣污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO兩種尾氣在催化劑作用下生成N2的熱化學方程式是_________________________。
(2)研究CO和NO的催化反應,用氣體傳感器測得在某溫度下、一定體積的密閉容器中,不同時間NO和CO濃度如下表:
時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(______)4mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(______)3mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s內的平均反應速率υ(CO) =______mol·L1·s1。
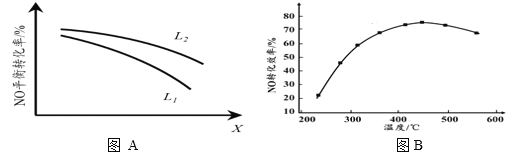
② L、X可分別代表壓強或溫度。下圖A表示L一定時,NO(g)的平衡轉化率隨X的變化關系。X代表的物理量是______。判斷L1、L2的大小關系,并簡述理由:______________________________。
(3)實驗測得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆為速率常數,只與溫度有關)。
①達到平衡后,僅升高溫度,k正增大的倍數______(填“>”、“
②若在2 L的密閉容器中充入1 mol CO和1 mol NO,在一定溫度下達到平衡時,CO的轉化率為40%,則k正︰k逆 =___________。(保留一位小數)
II. 有人利用反應C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭對NO進行吸附。現在密閉容器中加入足量的C和一定量的NO氣體并在催化劑作用下發生反應,經相同時間測得NO的轉化率隨溫度的變化如圖B所示。由圖可知最高轉化率對應溫度為450℃。低于450℃時,NO的轉化率是不是對應溫度下的平衡轉化率及判斷理由是________________________;
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭對NO進行吸附。現在密閉容器中加入足量的C和一定量的NO氣體并在催化劑作用下發生反應,經相同時間測得NO的轉化率隨溫度的變化如圖B所示。由圖可知最高轉化率對應溫度為450℃。低于450℃時,NO的轉化率是不是對應溫度下的平衡轉化率及判斷理由是________________________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生成水的能量關系如圖所示:下列說法不正確的是
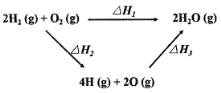
A.△H2>0
B.若2H2(g)+O2(g)=2H2O(l) △H4,則△H4<△H1
C.一定條件下,氣態原子生成1 mol H-O放出a kJ熱量,則該條件下△H3=-4akJ/mol
D.△H1+△H2+△H3=0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水電池常用在海上浮標等助航設備中,其示意圖如圖所示。電池反應為2Li+2H2O=2LiOH+H2↑。電池工作時,下列說法錯誤的是( )
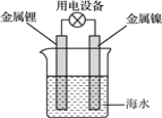
A.金屬鋰作負極
B.電子從鋰電極經導線流向鎳電極
C.海水作為電解質溶液
D.可將電能轉化為化學能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Cu2O是一種半導體材料,基于綠色化學理念設計的一種制取Cu2O的電解池示意圖如下,電池總反應為2Cu+H2O![]() Cu2O+H2↑。下列說法正確的是
Cu2O+H2↑。下列說法正確的是

A.石墨電極上產生氫氣
B.銅電極發生還原反應
C.銅電極接直流電源的負極
D.當有0.1mol電子轉移時,有0.1mol Cu2O生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物在工業上有重要用途。請回答下列有關問題:
(1)已知N2(g)+O2(g)=2NO(g) ΔH =+180.5kJ·mol-1,N2(g)+3H2(g) ![]() 2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,寫出氨氣經催化氧化完全生成一氧化氮和水蒸氣的熱化學方程式為_________
2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,寫出氨氣經催化氧化完全生成一氧化氮和水蒸氣的熱化學方程式為_________
(2)在一定體積的密閉容器中,進行如下化學反應:N2(g)+3H2(g) ![]() 2NH3(g),在恒溫恒壓下判斷該反應達到化學平衡狀態的依據是______(填序號);
2NH3(g),在恒溫恒壓下判斷該反應達到化學平衡狀態的依據是______(填序號);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器內壓強保持不變 D.混合氣體的密度保持不變
(3)在有氧條件下,新型催化劑M能催化![]() 與
與![]() 生成
生成![]() 。將一定比例的
。將一定比例的![]() 、
、![]() 和
和![]() 的混合氣體,勻速通入裝有催化劑M的反應器中反應(裝置見圖)。
的混合氣體,勻速通入裝有催化劑M的反應器中反應(裝置見圖)。
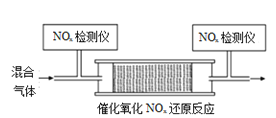
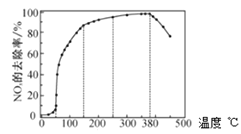
反應相同時間![]() 的去除率隨反應溫度的變化曲線如圖所示,在
的去除率隨反應溫度的變化曲線如圖所示,在![]() 范圍內隨著溫度的升高,
范圍內隨著溫度的升高,![]() 的去除率先迅速上升后上升緩慢,迅速上升段是催化劑活性隨溫度升高增大,與溫度升高共同使
的去除率先迅速上升后上升緩慢,迅速上升段是催化劑活性隨溫度升高增大,與溫度升高共同使![]() 去除反應速率迅速增大,上升階段緩慢主要是____________;當反應溫度高于
去除反應速率迅速增大,上升階段緩慢主要是____________;當反應溫度高于![]() 時,
時,![]() 的去除率迅速下降的原因可能是_________。
的去除率迅速下降的原因可能是_________。
(4)如圖為利用肼![]() —空氣燃料電池電解硫酸銅溶液的示意圖。
—空氣燃料電池電解硫酸銅溶液的示意圖。
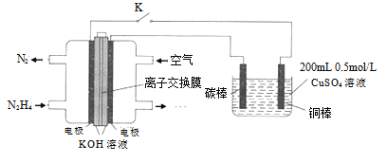
左圖負極反應式為:___________。當上圖陰極上放出2.24L氣體![]() 標準狀況
標準狀況![]() 時,圖中硫酸銅溶液的pH=______(溶液體積變化忽略不計)。
時,圖中硫酸銅溶液的pH=______(溶液體積變化忽略不計)。
(4)工業上生產尿素的化學方程式為:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(l)。在T℃,體積為4L的密閉容器中,通入6mol NH3和3mol CO2 。10min反應達到平衡,達到平衡時,c(NH3)=0.5mol·L-1。則10min內的平均反應速率υ(CO2)=_______mol·L-1·min-1。若此時保持T℃和平衡時容器的壓強不變,再向體積可變的容器中充入3mol NH3,則此時反應的v正____ v逆(填“>”“<”或“=”)。
CO(NH2)2(s)+H2O(l)。在T℃,體積為4L的密閉容器中,通入6mol NH3和3mol CO2 。10min反應達到平衡,達到平衡時,c(NH3)=0.5mol·L-1。則10min內的平均反應速率υ(CO2)=_______mol·L-1·min-1。若此時保持T℃和平衡時容器的壓強不變,再向體積可變的容器中充入3mol NH3,則此時反應的v正____ v逆(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com