
【題目】A、B、C、W均為中學常見的純凈物,它們之間有如下轉化關系(其它產物及反應條件已略去,反應可以在水溶液中進行):
![]()
Ⅰ.若A為有刺激性氣味的氣體,水溶液呈堿性;C為紅棕色氣體,與水反應生成一元強酸D,D具有強氧化性。
(1)A的電子式為___。
(2)在催化劑作用下,A與C反應可生成兩種無污染物質,該反應化學方程式為___。
(3)工業上常用過量的Na2CO3溶液吸收C,生成等物質的量的兩種硝酸鹽,該反應的離子方程式為___。
Ⅱ.若A、C、W都是常見氣體,C是導致酸雨的主要氣體,常溫下A與C反應生成B,則該反應的化學方程式為___。某化學活動小組將搜集到的一定量的酸雨保存在密閉容器中,每隔一定時間測酸雨的pH,發現在起始一段時間內,酸雨的pH呈減小趨勢,用離子方程式解釋原因:____。
Ⅲ.A、B、C三種物質的溶液均顯堿性,焰色反應均為黃色;C常作面包和糕點的發泡劑,受熱分解可生成B。
(1)若將標準狀況下2.24L的W通入150mL1mol·L-1的A溶液中,充分反應。總反應的離子方程式為____。
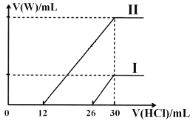
(2)向兩份30mL同濃度的A溶液中通入不同體積的W氣體,得到溶液M、N。向M、N溶液中逐滴加入濃度為0.2mol·L-1鹽酸,如圖所示,Ⅰ和Ⅱ分別為向M、N溶液中加入鹽酸的體積V(HCl)與產生W氣體的體積V(W)的關系。則M、N兩溶液中相同溶質的物質的量之比為___。
【答案】![]() 8NH3+6NO2
8NH3+6NO2![]() 7N2+12H2O 2NO2+2CO32-+H2O ===NO3-+NO2-+2HCO3- 2H2S+SO2=3S↓+2H2O 2H2SO3+O2=4H++2SO42- 2CO2+3OH-=CO32-+HCO3-+H2O 1∶3
7N2+12H2O 2NO2+2CO32-+H2O ===NO3-+NO2-+2HCO3- 2H2S+SO2=3S↓+2H2O 2H2SO3+O2=4H++2SO42- 2CO2+3OH-=CO32-+HCO3-+H2O 1∶3
【解析】
Ⅰ.若A為有刺激性氣味的氣體,水溶液呈堿性;C為紅棕色氣體,與水反應生成一元強酸D,D具有強氧化性。則A是氨氣、B是一氧化氮、C是二氧化氮、W是氧氣、D是硝酸。
Ⅱ.若A、C、W都是常見氣體,C是導致酸雨的主要氣體,C是二氧化硫,則A是硫化氫、B是S、W是氧氣;
Ⅲ.A、B、C三種物質的溶液均顯堿性,焰色反應均為黃色,說明都含鈉元素;C常作面包和糕點的發泡劑,受熱分解可生成B,則C是碳酸氫鈉,B是碳酸鈉,W是二氧化碳,A是氫氧化鈉。
Ⅰ.(1)A是氨氣,電子式為![]() 。
。
(2)在催化劑作用下,氨氣與二氧化氮反應生成的兩種無污染物質是氮氣和水,該反應化學方程式為8NH3+6NO2![]() 7N2+12H2O。
7N2+12H2O。
(3)Na2CO3溶液吸收二氧化氮,生成等物質的量的兩種硝酸鹽,根據得失電子守恒,生成的兩種硝酸鹽是硝酸鈉和亞硝酸鈉,該反應的離子方程式為2NO2+2CO32-+H2O ===NO3-+NO2-+2HCO3-。
Ⅱ.常溫下H2S與SO2發生氧化還原反應生成單質硫,該反應的化學方程式為2H2S+SO2=3S↓+2H2O。亞硫酸被氧化為硫酸,所以酸雨的pH呈減小趨勢,反應的離子方程式是2H2SO3+O2=4H++2SO42-。
Ⅲ.(1)標準狀況下,2.24L二氧化碳的物質的量是0.1mol, 150mL1mol·L-1的氫氧化鈉溶液中氫氧化鈉的物質的量是0.15mol,氫氧化鈉和二氧化碳的比是3:2,根據元素守恒,反應生成0.5mol碳酸鈉和0.5mol碳酸氫鈉。反應的離子方程式為2CO2+3OH-=CO32-+HCO3-+H2O。
(2)碳酸鈉溶液中逐滴滴入鹽酸,依次發生反應:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O;
依據情況Ⅰ可知,26-30段為碳酸氫鈉與鹽酸反應,則溶液中碳酸鈉消耗的鹽酸體積為30-26=4ml,說明溶質為碳酸鈉與氫氧化鈉混合物,依據方程式:Na2CO3+HCl=NaHCO3+NaCl,碳酸鈉的物質的量為:0.004L×0.2molL-1=0.0008mol;
依據情況Ⅱ知,12-30段為碳酸氫鈉與鹽酸反應,若溶質為碳酸鈉則溶液中碳酸鈉消耗的鹽酸體積為30-12=18mL,而Ⅱ中0-12mL<18mL,說明Ⅱ中溶質為碳酸鈉和碳酸氫鈉,前12mL鹽酸為碳酸鈉與鹽酸反應生成碳酸氫鈉,依據Na2CO3+HCl=NaHCO3+NaCl,碳酸鈉的物質的量為:0.012L×0.2molL-1=0.0024mol;所以M、N兩溶液中相同組分溶質碳酸鈉的物質的量之比為:0.0008mol;0.0024mol=1:3。


 輕松暑假總復習系列答案
輕松暑假總復習系列答案科目:高中化學 來源: 題型:
【題目】下列說法正確的有幾個 ( )
①重水的化學式為T2O
②CO2的比例模型:![]()
③H2O2的電子式:![]()
④硅酸鹽Ca2 Mg5 Si8 O22(OH)2可用氧化物形式表示為:2CaO﹒5MgO﹒8SiO2 ﹒H2O
⑤硅膠有吸水性,是常用的食品干燥劑
⑥醫療上常用乙醇體積分數為95%的酒精殺菌消
⑦聚四氟乙烯耐酸堿腐蝕,可用作化工反應器的內壁涂層
⑧水中的鋼閘門連接電源的負極屬于犧牲陽極的陰極保護法
⑨食鹽可作調味劑,也可作食品防腐劑
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A(C6H6O)是一種重要的化工原料,廣泛用于制造樹脂、醫藥等。
Ⅰ.以A、B為原料合成扁桃酸衍生F的路線如下。

(1)A的名稱是____;B的結構簡式是____。
(2)C(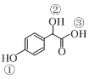 )中①~③羥基氫原子的活性由強到弱的順序是____。
)中①~③羥基氫原子的活性由強到弱的順序是____。
(3)D的結構簡式是____。
(4)寫出F與過量NaOH溶液反應的化學方程式:___________。
(5)若E分子中含有3個六元環,則E的結構簡式是________。
Ⅱ.以A為原料合成重要的醫藥中間體K的路線如下。
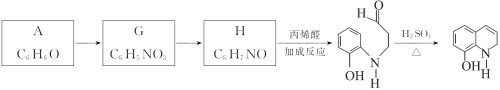
(6)G→H的反應類型是__________。
(7)一定條件下,K與G反應生成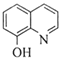 、H和水,化學方程式是__________。
、H和水,化學方程式是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某酸性工業廢水中含有一定量的Fe3+、Cu2+、Au3+等離子。利用常用的酸、堿和工業生產中的廢鐵屑,設計如下工藝流程,從廢水中回收金,并生產一定量的鐵紅和氧化銅。
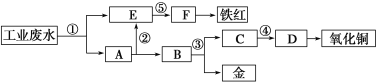
下列說法不正確的是( )
A.標號①②③處發生的反應均為氧化還原反應
B.標號③處加入的相應物質是稀硝酸或稀硫酸
C.標號①處發生的離子反應最多有三個
D.鐵紅的化學式為Fe2O3,工業上常用作紅色顏料
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數的值,下列敘述正確的是
A.標準狀況下,2.24L三氧化硫中所含分子數約為0.1NA
B.10mL質量分數為98%的H2SO4,用水稀釋至100mL,H2SO4的質量分數大于9.8%
C.一定溫度下,1moLFeCl3可生成NA個Fe(OH)3膠體顆粒
D.在H2O2+Cl2=2HCl+O2反應中,每生成32g氧氣,則轉移NA個電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無機非金屬材料、金屬材料和有機高分子材料并稱為三大材料,是發展高新技術的基石,在未來科技發展中發揮著重要的作用。
(1)Nierite是一種高熔點高硬度的陶瓷材料。Nierite的摩爾質量為140 g/mol,其中硅元素的質量分數為60%。已知1 mol NH3與足量的SiCl4充分反應后可得到35 g Nierite與3 mol HCl氣體。Nierite的化學式為___________。
(2)K金是常見的貴金屬材料,除黃金外,還含有銀、銅中的一種或兩種金屬。為測定某18K金樣品的組成,將2.832 g樣品粉碎后投入足量的濃硝酸中,固體全部溶解后,收集到NO2和N2O4的混合氣體224 mL(折算至標準狀況,下同),將該混合氣體與84 mL O2混合后緩緩通入水中,恰好被完全吸收。
填寫該18K金的成分表(精確至0.01%,若不含該金屬則填0)。
18K金成分 | Au | Ag |
含量(質量分數) | 75.00% | _________ |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】滴有酚酞的Ba(OH)2溶液顯紅色,在上述溶液中分別滴加X溶液后有下列現象。下列說法不正確的是( )

A.實驗I中溶液紅色褪去,說明發生了反應H++OH-![]() H2O
H2O
B.實驗II中溶液紅色不變,且燈泡亮度沒有明顯變化,說明溶液中仍然存在大量的Na+與OH
C.實驗III中溶液紅色褪去,有白色沉淀生成,燈泡逐漸變暗,說明發生了反應2H++SO42-+Ba2++2OH-= 2H2O+BaSO4↓
D.將實驗II中Na2SO4溶液換成CuSO4溶液,現象與原實驗II中的現象相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將Cu片放入0.1mol/LFeCl3溶液中,反應一定時間后取出(溶液體積變化忽略不計),所得溶液Q中的![]() ,下列有關說法正確的是
,下列有關說法正確的是
A. 溶液Q比原溶液增重了1.92g.
B. Q中n(Cu2+):n(Fe3+)=3:4
C. 反應中轉移的電子數為0.04mol
D. n(Cu2+)=0.03mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨做電極電解此溶液,當通電一段時間后,兩極均收集到22.4 L氣體(標準狀況),假定電解后溶液體積仍為500 mL,下列說法正確的是( )
A. 原混合溶液中c(K+)為2 mol·L-1
B. 上述電解過程中共轉移6 mol電子
C. 電解得到的Cu的物質的量為0.5 mol
D. 電解后溶液中c(H+)為2 mol·L-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com