
【題目】已知同溫、同濃度時,酸性:H2SO3>H2CO3>HSO3- >HCO3-
【1】用方程式表示NaHSO3溶液中存在的三個平衡體系(不考慮亞硫酸的分解):
①_________、②_________、③_________。
【2】0.1 mol L-1 的 NaHSO3溶液中離子濃度:c(SO32-)______c(HSO3-)(填 “>”、“<”或“=”);要使其中的c(H+)和c(SO32-)都減小,可行的方法是________________。
A 加入過量CaO(s) B 加入少量NaOH(s) C 通入過量HCl(g) D 加入少量的H2O2(aq)
【3】0.1mol L的Na2SO3溶液呈____性(填“酸”、“堿”或“中”),其電荷守恒式: c(Na+)+c(H+)=_______。
【4】H2SO3和NaHCO3溶液的離子方程式為:___________。
【5】NaHSO3溶液在不同溫度下均可被過量KIO3酸性溶液氧化,當NaHSO3完全消耗即I2有析出,寫出該反應的離子方程式:___________。
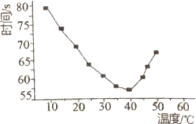
【6】將NaHSO3(含少量淀粉)和酸性溶液KIO3(過量)混合,記錄10-50℃間溶液變藍時間,實驗結果見下圖。請描述曲線變化的規律________。
【答案】
【1】 HSO3- +H2O ![]() H2SO3+OH- HSO3-
H2SO3+OH- HSO3- ![]() SO32-+ H+ H2O
SO32-+ H+ H2O![]() H++OH-
H++OH-
【2】 > A
【3】 堿 c(Na+) + c(H+) = 2c(SO32-) + c(HSO3-)+c(OH-)
【4】H2SO3 + HCO3- = CO2↑+HSO3-+H2O
【5】5HSO3- + 2IO3- = 5SO42- + I2 + H2O +3H+
【6】溫度低于40℃之前,溫度越高,反應速率越快,變藍時間越短,溫度高于40℃低于50℃,溶液變藍時間變長
【解析】
亞硫酸鈉溶液中存在三個平衡,水的電離、亞硫酸根的電離、亞硫酸根的水解,
亞硫酸根主要是電離為主,水解次要,利用平衡移動原理分析離子濃度的變化,
利用酸性強弱書寫離子方程式,
利用氧化還原反應原理來配平離子方程式,
讀圖像,根據圖像變化趨勢分析化學問題。
【1】NaHSO3溶液中存在的三個平衡體系分別是亞硫酸氫根的水解,亞硫酸根的電離,水的電離,離子方程式分別為HSO3- +H2O ![]() H2SO3+OH-,HSO3-
H2SO3+OH-,HSO3- ![]() SO32-+ H+,H2O
SO32-+ H+,H2O![]() H++OH-,
H++OH-,
故答案為:HSO3- +H2O ![]() H2SO3+OH-;HSO3-
H2SO3+OH-;HSO3- ![]() SO32-+ H+;H2O
SO32-+ H+;H2O![]() H++OH-;
H++OH-;
【2】0.1 mol L-1 的 NaHSO3溶液中,HSO3- +H2O ![]() H2SO3+OH-,HSO3-
H2SO3+OH-,HSO3- ![]() SO32-+ H+,電離平衡大于水解平衡,因此離子濃度:c(SO32-) > c(HSO3-);
SO32-+ H+,電離平衡大于水解平衡,因此離子濃度:c(SO32-) > c(HSO3-);
要使其中的c(H+)和c(SO32-)都減小,
A選項,過量CaO(s)和氫離子反應生成水和鈣離子,鈣離子又和亞硫酸根反應生成亞硫酸鈣沉淀,故A正確;
B選項,少量NaOH(s)和氫離子反應,HSO3- ![]() SO32-+ +,平衡正向移動,亞硫酸根離子濃度增大,故B錯誤;
SO32-+ +,平衡正向移動,亞硫酸根離子濃度增大,故B錯誤;
C選項,通入過量HCl(g),平衡逆向移動,氫離子濃度增大,故C錯誤;
D選項,加入少量的H2O2(aq),雙氧水和亞硫酸根反應生成硫酸根、氫離子和水,氫離子濃度增大,故D錯誤;
綜上所述,答案為A,
故答案為:>;A;
【3】0.1mol L的Na2SO3溶液,由于亞硫酸根水解,強堿弱酸鹽,水解顯堿性,根據電荷守恒,陽離子所帶電荷等于陰離子所帶電荷,其電荷守恒式:c(Na+) + c(H+) = 2c(SO32-) + c(HSO3-)+c(OH-),
故答案為:堿;c(Na+) + c(H+) = 2c(SO32-) + c(HSO3-)+c(OH-);
【4】由于酸性大小順序為:H2SO3>H2CO3>HSO3->HCO3-
因此H2SO3和NaHCO3溶液的離子方程式為:H2SO3 + HCO3- = CO2↑+HSO3-+H2O,
故答案為:H2SO3 + HCO3- = CO2↑+HSO3-+H2O;
【5】NaHSO3溶液在不同溫度下均可被過量KIO3酸性溶液氧化,當NaHSO3完全消耗即I2有析出,按照化合價升降守恒,NaHSO3升高2個價態,生成I2降低10個價態,NaHSO3系數配5,I2系數配1,KIO3系數配2,因此該反應的離子方程式:
5HSO3- + 2IO3- = 5SO42- + I2 + H2O +3H+,
故答案為:5HSO3- + 2IO3- = 5SO42- + I2 + H2O +3H+;
【6】6. 將NaHSO3(含少量淀粉)和酸性溶液KIO3(過量)混合,記錄10-50℃間溶液變藍時間,實驗結果見下圖。請描述曲線變化的規律溫度低于40℃之前,溫度越高,反應速率越快,變藍時間越短,溫度高于40℃低于50℃,溶液變藍時間變長,溫度高于50℃,淀粉不適宜作指示劑,
故答案為:溫度低于40℃之前,溫度越高,反應速率越快,變藍時間越短,溫度高于40℃低于50℃,溶液變藍時間變長。


科目:高中化學 來源: 題型:
【題目】室溫下,下列說法正確的是
A.將pH均為a的氫氧化鈉溶液和氨水分別加水稀釋100倍,pH變為b和c,則a、b、c的大小關系是:a>b>c
B.KNO3溶液和CH3OOONH4溶液pH均為7,但兩溶液中水的電離程度不相同
C.5.0×10-3 mol·L-1KHA溶液的pH=3.75,該溶液中c(A2-)<c(H2A)
D.己知某分散系中存在:M(OH)2(s)![]() M2+(aq)+2OH-(aq),K=a,c(M2+)=b mol·L-1時,溶液的pH等于
M2+(aq)+2OH-(aq),K=a,c(M2+)=b mol·L-1時,溶液的pH等于![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[物質結構與性質]
繼密胺樹脂/石墨烯量子點復合微球新型白光發光材料后,2019年8月13日中國科學院福建物質結構研究所合成了首例缺陷誘導的晶態無機硼酸鹽單一組分白光材料![]() 并獲得了該化合物的LED器件。
并獲得了該化合物的LED器件。
(1)基態O原子能量最高的電子,其電子云在空間有______個延展方向;C原子的基態電子排布式為______;
(2)![]() 與
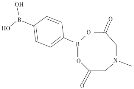
與![]() 互為等電子體,構型為_______;苯-1,4-二硼酸甲基亞氨基二乙酸酯結構如圖所示,硼原子和氮原子的雜化方式分別為__________、__________。
互為等電子體,構型為_______;苯-1,4-二硼酸甲基亞氨基二乙酸酯結構如圖所示,硼原子和氮原子的雜化方式分別為__________、__________。
(3)石墨的熔點大于金剛石的熔點,試分析原因:________。
(4)![]() 可用
可用![]() 檢驗,其對應的酸有兩種,分別為硫氰酸(HSC≡N)和異硫氰酸(HN=C=S),這兩種酸中沸點較高的是____________,試分析原因:_________;熱穩定性:
檢驗,其對應的酸有兩種,分別為硫氰酸(HSC≡N)和異硫氰酸(HN=C=S),這兩種酸中沸點較高的是____________,試分析原因:_________;熱穩定性:![]() _______(填“<”“>”或“=”)
_______(填“<”“>”或“=”)![]() 。
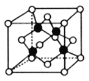
。
(5)超高熱導率半導體材料——砷化硼(BAs)晶胞結構如圖所示(As位于體內,B位于頂點和面心),已知晶胞參數為a pm,阿伏加德羅常數的值為![]() ,As原子到B原子最近距離為________(用含a的式子表示),該晶體的密度是_______g.cm-3 (列出含a、
,As原子到B原子最近距離為________(用含a的式子表示),該晶體的密度是_______g.cm-3 (列出含a、![]() 的計算式即可)。
的計算式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向100 mL NaOH溶液中通入一定量的CO2氣體,充分反應后,再向所得溶液中逐滴加入0.2 mol·L-1的鹽酸,產生CO2的體積與所加鹽酸體積之間關系如圖所示。下列判斷正確的是( )

A. 原NaOH溶液的濃度為0.2 mol·L-1
B. 通入CO2在標準狀況下的體積為448 mL
C. 所得溶液的溶質成分的物質的量之比為n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶質成分的物質的量之比為n(NaHCO3)∶n(Na2CO3)=1∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化鈉常用作漂白劑、殺菌劑、消毒劑,能與水和二氧化碳等物質發生反應,保存不當時容易變質。某實驗小組以過氧化鈉為研究對象進行了如下實驗。
(1)探究一包Na2O2樣品是否已經變質:取少量樣品,將其溶解,加入__________溶液,充分振蕩后有白色沉淀,證明Na2O2已經變質。
(2)該實驗小組為了粗略測定過氧化鈉的質量分數,稱取了m g樣品,并設計用下圖裝置來測定過氧化鈉的質量分數。
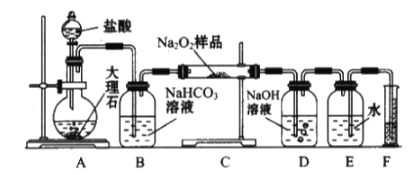
①裝置中用于滴加鹽酸的儀器的名稱是_________,裝置D的作用是_________________________________;
②將儀器連接好以后,必須進行的第一步操作是_________________________________;
③寫出裝置C中發生主要反應的化學方程式_________________________________;
④反應結束后,在讀取實驗中生成氣體的體積時,你認為合理的是_______________(填序號);
a.讀取氣體體積前,需冷卻到室溫
b.調整量筒使E、F內液面高度相同
e.視線與凹液面的最低點相平時讀取量筒中水的體積
⑤讀出量筒內水的體積后,將其折算成標準狀況下氧氣的體積為VmL,則樣品中過氧化鈉的質量分數為______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】茉莉花香氣的成分有多種,有機物E (C9H10O2)是其中的一種,它可以從茉莉花中提取,也可以用酒精和苯的某一同系物(C7H8)為原料進行人工合成,合成路線如下:
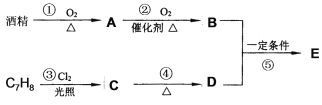
【1】C物質中官能團的名稱是:___________。
【2】③的有機反應類型是:_______________。
【3】反應④發生還需要的試劑是:_____________。
【4】寫出反應⑤的化學方程式:______________。
【5】證明反應②中A物質己完全轉化為B物質的方法是:________________。
【6】E的同分異構體中,苯環上只有一個取代基,并包含一個酯基的結構有多個,下面是其中2個的結構簡式:
![]() 、
、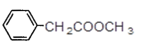
請再寫出2個符合上述要求的E的同分異構體結構簡式:______和__________
【7】請寫出以CH2=CHCH2CH3為唯一有機原料制備CH2=CHCH=CH2的合成路線(無機試劑任選)________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿式碳酸鎂[4MgCO3·Mg(OH)2·4H2O]是一種重要的無機化工產品。一種由白云石[主要成分為CaMg(CO3)2,含少量SiO2、Fe2O3等]為原料制備堿式碳酸鎂(國家標準中CaO的質量分數≤0.43%)的實驗流程如下:
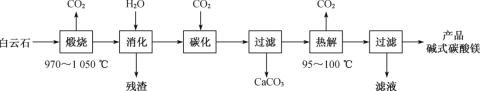
(1)“煅燒”時發生主要反應的化學方程式為___。
(2)常溫常壓下,“碳化”可使鎂元素轉化為Mg(HCO3)2,“碳化”時終點pH對最終產品中CaO含量及堿式碳酸鎂產率的影響如圖1和圖2所示。
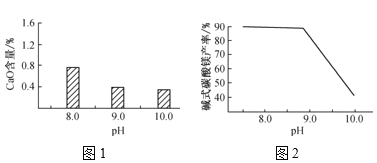
①應控制“碳化”終點pH約為___,鈣元素的主要存在形式是___(填化學式)。
②根據圖2,當pH=10.0時,鎂元素的主要存在形式是___(填化學式)。
(3)“熱解”生成堿式碳酸鎂的化學方程式為___。
(4)該工藝為達到清潔生產,可以循環利用的物質是___(填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學課外小組為了鑒別碳酸鈉和碳酸氫鈉兩種白色固體,用不同的方法做了以下實驗,如圖Ⅰ-Ⅳ所示。
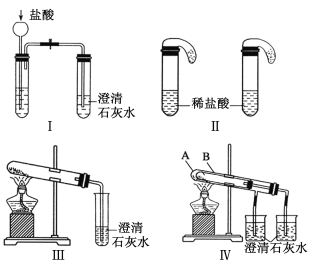
(1)只根據圖Ⅰ、Ⅱ所示實驗,能夠達到實驗目的的是(填裝置序號)___________;
(2)圖Ⅲ、Ⅳ所示實驗均能鑒別這兩種物質,其反應的化學方程式為___________;
與實驗Ⅲ相比,實驗Ⅳ的優點是(填選項序號)_____;
A.Ⅳ比Ⅲ復雜 B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作簡便 D.Ⅳ可以做到一套裝置同時進行兩個對比實驗,而Ⅲ不能
(3)若用實驗裝置Ⅳ驗證碳酸鈉和碳酸氫鈉的穩定性,則試管B中裝入的固體最好是______;
(4)將碳酸氫鈉溶液與澄清石灰水混合并充分反應,
①當石灰水過量時,其離子方程式是_____________;
②當碳酸氫鈉與氫氧化鈣物質的量之比為2:1時,所得溶液中溶質的化學式為______,請設計實驗檢驗所得溶液中溶質的陰離子__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com