
【題目】苯乙烯是一種重要的有機化工原料,其結構簡式為![]() ,它一般不可能具有的性質是( )
,它一般不可能具有的性質是( )
A.難溶于水,易溶于有機溶劑,在空氣中燃燒產生黑煙
B.分子中的所有原子一定在同一平面內
C.它能使溴的四氯化碳溶液褪色,也能使酸性高錳酸鉀溶液褪色
D.能發生加成反應,在一定條件下最多可與四倍物質的量的氫氣加成
【答案】B
【解析】
A. 苯乙烯屬于烴類,難溶于水,易溶于有機溶劑,其分子式為C8H8,碳的含量較高,在空氣中燃燒產生黑煙,A不符合題意;
B. 苯乙烯是一個苯基取代乙烯的一個氫,或一個乙烯基取代苯的一個氫形成的,乙烯所有原子共平面,苯的所有原子共平面,但由于乙烯和苯環相連接的是單鍵,它是可以任意旋轉的,所以苯乙烯中所以原子可能在同一平面內,也可能不在同一平面內,B符合題意;
C. 含有碳碳雙鍵,可與溴的四氯化碳溶液發生加成反應使之褪色,可被酸性高錳酸鉀氧化使酸性高錳酸鉀溶液褪色,C不符合題意;
D. 1mol 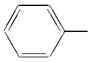 能與3mol H2發生加成反應,1mol
能與3mol H2發生加成反應,1mol 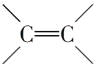 能與1mol H2發生加成反應,故與四倍物質的量的氫氣發生加成反應,D不符合題意;
能與1mol H2發生加成反應,故與四倍物質的量的氫氣發生加成反應,D不符合題意;
故答案為:B。


科目:高中化學 來源: 題型:
【題目】碳跟濃硫酸共熱產生的氣體X和銅跟濃硝酸反應產生的氣體Y同時通入盛有足量氯化鋇溶液的洗氣瓶中(如圖裝置),下列有關說法正確的是( )
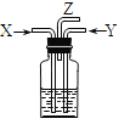
A.洗氣瓶中產生的沉淀是碳酸鋇
B.洗氣瓶中產生的沉淀是硫酸鋇
C.在Z導管出來的氣體中沒有二氧化碳
D.在Z導管口排出無色氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各項比較中,一定相等的是
A.等物質的量的OH-和-OH中所含電子數
B.等質量的氧氣和臭氧中含有的氧原子數目
C.1molNa2O2固體中陽離子與陰離子的數目
D.等物質的量的Cu與Fe分別與足量的稀硝酸反應時轉移的電子數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙二酸(H2C2O4)俗稱草酸,為無色晶體,是二元弱酸,其電離常數Ka1=5.4×10![]() ,Ka2=5.4×10
,Ka2=5.4×10![]() 。回答下列問題:
。回答下列問題:
(1)向10 mL0.1mol·L![]() H2C2O4溶液中逐滴加入0.1mol·L
H2C2O4溶液中逐滴加入0.1mol·L![]() NaOH溶液
NaOH溶液
①當溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)時,加入V(NaOH)___________10 mL(填“>”“=”或“<”)。
②隨著苛性鈉的加入,H+逐漸減少,當溶液中含碳粒子的主要存在形態為C2O42-時,溶液的酸堿性為____________(填標號)。
A.強酸性 B.弱酸性 C.中性 D.堿性
(2)某同學設計實驗測定含雜質的草酸晶體(H2C2O4·2H2O)純度(雜質不與酸性高錳酸鉀反應)。實驗過程如下:稱取m g草酸晶體于試管中,加水完全溶解,用c mol·L![]() KMnO4標準溶液進行滴定
KMnO4標準溶液進行滴定
①通常高錳酸鉀需要酸化才能進行實驗,通常用_________酸化
A.硫酸 B.鹽酸 C.硝酸 D.石炭酸
②則達到滴定終點時的現象是_____________________;
③該過程中發生反應的離子方程式為___________________________;
④滴定過程中消耗V mL KMnO4標準溶液,草酸晶體純度為_________________。
(3)醫學研究表明,腎結石主要是由CaC2O4 組成的,已知Ksp(CaC2O4)=2.3×10-9,若血液經血小球過濾后,形成的尿液為200 mL,其中含有Ca2+ 0.01 g。為了不形成CaC2O4 沉淀,則C2O42-的最高濃度為______ mol·L![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數值。下列有關敘述正確的是( )
A. 14 g乙烯和丙烯混合氣體中的氫原子數為2NA
B. 1 mol N2與4 mol H2反應生成的NH3分子數為2NA
C. 1 mol Fe溶于過量硝酸,電子轉移數為2NA
D. 標準狀況下,2.24 L CCl4含有的共價鍵數為0.4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知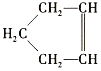 可簡寫為
可簡寫為![]() ,降冰片烯的分子結構可表示為
,降冰片烯的分子結構可表示為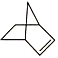 。
。
(1)降冰片烯屬于(___________)(填序號)
A.環烴 B.不飽和烴 C.烷烴 D.芳香烴
(2)降冰片烯的分子式為__。
(3)降冰片烯不具有的性質是(___________)(填序號)
A.能溶于水 B.能發生氧化反應
C.能發生加成反應 D.常溫常壓下為氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】迷迭香酸是從蜂花屬植物中提取得到的酸性物質,其結構簡式如圖所示。下列敘述正確的是 ( )

A. 迷迭香酸與溴單質只能發生取代反應
B. 1 mol迷迭香酸最多能和9 mol氫氣發生加成反應
C. 迷迭香酸可以發生水解反應、取代反應、消去反應和酯化反應
D. 1 mol迷迭香酸最多能和6 mol NaOH發生反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某無色溶液中含有K+、Cl-、OH-、SO32-、SO42-,為檢驗溶液中所含的某些陰離子,限用的試劑有:鹽酸、硝酸、硝酸銀溶液、硝酸鋇溶液、溴水和酚酞試液。檢驗其中OH-的實驗方法省略,檢驗其他陰離子的過程如下圖所示。

(1)圖中試劑①~⑤溶質的化學式分別是:
①________,②________,③________,④__________,⑤__________。
(2)圖中現象c表明檢驗出的離子是________________。
(3)白色沉淀A若加試劑③而不加試劑②,對實驗的影響是____________________。
(4)氣體E通入試劑④發生反應的離子方程式是_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】富馬酸亞鐵,是一種治療缺鐵性貧血的安全有效的鐵制劑。富馬酸在適當的pH條件下與FeSO4反應得富馬酸亞鐵。
已知:
物質名稱 | 化學式 | 相對分子質量 | 電離常數(25℃) |
富馬酸 | C4H4O4 | 116 | K1=9.5×10-4,K2=4.2×10-5 |
碳酸 | H2CO3 | K1=4.4×10-7,K2=4.7×10-11 | |
富馬酸亞鐵 | FeC4H2O4 | 170 |
i.制備富馬酸亞鐵:
①將富馬酸置于100 mL燒杯A中,加熱水攪拌
②加入Na2CO3溶液10 mL使溶液pH為6.5~6.7。并將上述溶液移至100 mL容器B中
③安裝好回流裝置C,加熱至沸。然后通過恒壓滴液漏斗D緩慢加入FeSO4溶液30 mL
④維持反應溫度100℃,充分攪拌1.5小時。冷卻,減壓過濾,用水洗滌沉淀
⑤最后水浴干燥,得棕紅(或棕)色粉末,記錄產量。
請回答以下問題:
(1)該實驗涉及到的主要儀器需從以下各項選擇,則B為_________(填字母),C為___________(填名稱);

(2)己知反應容器中反應物FeSO4和富馬酸按恰好完全反應的比例進行起始投料,寫出步驟②中加入Na2CO3溶液調節pH的目的是_____________,若加入Na2CO3溶液過量,對實驗的影響是_____________;
(3)所需FeSO4溶液應現用現配,用FeSO4·7H2O固體配置FeSO4溶液的方法為:__________;
(4)寫出容器B中制備富馬酸亞鐵的化學方程式:___________;
(5)步驟④檢驗沉淀是否洗凈的方法是:________________;
ii. 計算產品的產率:
(6)經測定,產品中富馬酸亞鐵的純度為76.5%、以5.80 g富馬酸為原料反應制得產品8.50 g,則富馬酸亞鐵的產率為______________%(保留小數點后一位)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com