
【題目】ZrO2是重要的耐溫材料,可用作陶瓷遮光劑。天然鋯英石(ZrSiO4)含有鐵、鋁、銅等金屬元素的氧化物雜質,工業以鋯英石為原料制備ZrO2的工藝流程如下: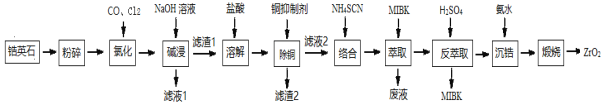
已知:①鋯英石中鋯元素的化合價為+4 ,“氯化”過程中除C、O元素外,其他元素均轉化為最高價氯化物 ②SiCl4極易水解;ZrCl4易溶于水 ③Fe(SCN)3難溶于有機溶劑MIBK; Zr(SCN)4在水中溶解度不大,易溶于有機溶劑MIBK。
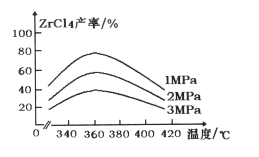
(1) “氯化”過程中,鋯英石發生的主要反應的化學方程式為:______________________________,ZrC14的產率隨溫度變化如圖所示,由圖可知氯化的最佳條件是_____________;
(2)“濾液1”中含有的陰離子除OH- 、Cl-,還有___________________;
(3)常用的銅抑制劑有Na2S、H2S、NaCN等,本流程使用NaCN除銅,不采用Na2S、H2S的原因是__________。
(4)實驗室進行萃取和反萃取的玻璃儀器是_______。流程中萃取與反萃取的目的是_________。
【答案】)ZrSiO4+4CO+4Cl2 ![]() ZrCl4 +SiCl4+4CO2 360℃、1MPa AlO2- 、SiO32- S2-會將Fe3+還原成Fe2+,影響下一步除鐵,同時可能會產生污染性氣體 分液漏斗、燒杯 除去鐵元素雜質
ZrCl4 +SiCl4+4CO2 360℃、1MPa AlO2- 、SiO32- S2-會將Fe3+還原成Fe2+,影響下一步除鐵,同時可能會產生污染性氣體 分液漏斗、燒杯 除去鐵元素雜質
【解析】
根據流程:天然鋯石的主要成分是ZrSiO4(還常含有Fe、Al、Cu的氧化物雜質),將粉碎后的天然鋯石用CO、Cl2氯化得到ZrCl4、SiCl4、AlCl3、FeCl3、CuCl2;用NaOH溶液堿浸時,SiCl4、AlCl3溶解為硅酸鈉、偏鋁酸鈉,ZrCl4、FeCl3、CuCl2反應為Zr(OH)4、Fe(OH)3、Cu(OH)2沉淀,即為濾渣1;用鹽酸溶解濾渣1得到ZrCl4、FeCl3、CuCl2;加入銅抑制劑除去銅[銅抑制劑可以為NaCN,生成沉淀為Cu(CN)2],濾渣2為Cu(CN)2;向濾液2加入NH4SCN與ZrCl4、FeCl3發生配合反應得到Fe(SCN)3、Zr(SCN)4,加入 有機溶劑MIBK萃取,Fe(SCN)3難溶于MIBK,分液,Zr(SCN)4在有機層,將含有Zr(SCN)4的有機層用硫酸反萃取將Zr(SCN)4與MIBK分離;通入氨氣沉鋯,經過煅燒得到ZrO2,據此分析作答。
(1) 氯化過程中ZrSiO4與CO、Cl2在高溫下反應生成ZnCl4、SiCl4和CO2,反應的化學方程式為:ZrSiO4+4CO+4Cl2![]() ZnCl4+SiCl4+4CO2;由圖可知,360℃、1MPa時,ZrCl4產率最高,此為氯化最佳條件;
ZnCl4+SiCl4+4CO2;由圖可知,360℃、1MPa時,ZrCl4產率最高,此為氯化最佳條件;
(2)由流程分析可知,“濾液1”中含有的陰離子除OH- 、Cl-,還有AlO2- 、SiO32-;
(3)三價鐵具有氧化性,S2-會將Fe3+還原成Fe2+,發生的反應為2Fe3++H2S=2Fe2++S+2H+(2Fe3++S2-=2Fe2++S),影響下一步除鐵,同時可能會產生污染性H2S氣體,故本流程使用NaCN除銅,不采用Na2S、H2S;
(4)實驗室進行萃取和反萃取的玻璃儀器是分液漏斗、燒杯;根據已知信息“生成的Fe(SCN)3難溶于MIBK,Zr(SCN)4在水中的溶解度小于在MIBK中的溶解度”可知,流程中萃取與反萃取的目的是除去鐵元素雜質。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A. 向![]() 溶液中加入少量氨水:
溶液中加入少量氨水:![]() ==Al(OH)3
==Al(OH)3![]()
B. 向![]() 溶液中加入KOH溶液:HCO3-+OH-═H2O+CO2↑
溶液中加入KOH溶液:HCO3-+OH-═H2O+CO2↑
C. 向![]() 溶液中加入過量的NaOH溶液:
溶液中加入過量的NaOH溶液:![]()
D. 向![]() 溶液中加入過量澄清石灰水:
溶液中加入過量澄清石灰水:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放熱且產生氣體,可用于冬天石油開采。下列表示反應中相關微粒的化學用語正確的是
NaCl+N2↑+2H2O放熱且產生氣體,可用于冬天石油開采。下列表示反應中相關微粒的化學用語正確的是
A. 中子數為18的氯原子:![]()
B. N2的結構式:N=N
C. Na+的結構示意圖: 
D. H2O的電子式: ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學——選修3:物質結構與性質]
鋅在工業中有重要作用,也是人體必需的微量元素。回答下列問題:
(1)Zn原子核外電子排布式為________________。
(2)黃銅是人類最早使用的合金之一,主要由Zn和Cu組成。第一電離能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有較高的熔點(872 ℃),其化學鍵類型是_________;ZnF2不溶于有機溶劑而ZnCl2、ZnBr2、ZnI2能夠溶于乙醇、乙醚等有機溶劑,原因是________________。
(4)《中華本草》等中醫典籍中,記載了爐甘石(ZnCO3)入藥,可用于治療皮膚炎癥或表面創傷。ZnCO3中,陰離子空間構型為________________,C原子的雜化形式為________________。
(5)金屬Zn晶體中的原子堆積方式如圖所示,這種堆積方式稱為_______________。六棱柱底邊邊長為a cm,高為c cm,阿伏加德羅常數的值為NA,Zn的密度為________________g·cm-3(列出計算式)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖為幾種化合物的元素組成示意圖,以下說法錯誤的是

A. 若①為某種具有催化作用的化合物,則其水解產物為氨基酸
B. 若②為脂肪,則其大量積累于皮下和內臟器官周圍
C. 若③為藍藻的遺傳物質,則其和蛋白質組成染色體
D. 若④為糖原,則其主要分布在人和動物的肌肉和肝臟中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的鹽酸,恰好使混合物完全溶解,放出224mL(標準狀況)的氣體,所得溶液中加入KSCN溶液無血紅色出現。若用足量的CO在高溫下還原相同質量的此混合物,能得到鐵的質量是( )
A. 11.2gB. 5.6gC. 2.8gD. 無法計算
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知![]() 、
、![]() 、
、![]() 、
、![]() 為原子序數依次增大的短周期元素,
為原子序數依次增大的短周期元素,![]() 為地殼中含量最高的過渡金屬元素,
為地殼中含量最高的過渡金屬元素,![]() 與
與![]() 同主族,
同主族,![]() 與
與![]() 同周期,且
同周期,且![]() 與
與![]() 的原子序數之和為20。甲、乙分別為元素E、A的單質, 丙、丁為A、E分別與B形成的二元化合物,它們轉化關系如圖所示。下列說法不正確的是( )
的原子序數之和為20。甲、乙分別為元素E、A的單質, 丙、丁為A、E分別與B形成的二元化合物,它們轉化關系如圖所示。下列說法不正確的是( )
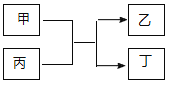
A.![]() 、
、![]() 形成的一種化合物具有漂白性
形成的一種化合物具有漂白性
B.![]() 、
、![]() 形成的離子化合物可能含有非極性鍵
形成的離子化合物可能含有非極性鍵
C.![]() 的單質能與丙反應置換出
的單質能與丙反應置換出![]() 的單質
的單質
D.丁為黑色固體,且1mol甲與足量丙反應轉移電子3 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(9分)如下圖裝置實驗,A、B兩燒杯分別盛放200 g10%NaOH和足量CuSO4溶液。通電一段時間后,c極上有Cu析出,又測得A杯中溶液的質量減少4.5 g(不考慮水的蒸發)。
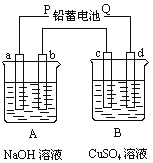
請回答下列問題:
(1)電源P極為 極;請分別寫出b極和c極上發生的電極反應 式: ;
(2)c極上析出固體銅的質量為 g
(3)若裝置中用鉛蓄電池作電源,已知鉛蓄電池放電時發生如下反應:
負極:Pb+SO42 -=PbSO4+2e-
正極:PbO2+4H++SO42 -+2e-=PbSO4+2H2O
假設在a極制得氣體0.050 mol,這時電池內消耗的H2SO4的物質的量至少是 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨對人類的生產生活具有重要影響。
(1)氨的制備與利用。
① 工業合成氨的化學方程式是____________。
②氨催化氧化生成一氧化氮反應的化學方程式是___________。
(2)氨的定量檢測。水體中氨氣和銨根離子(統稱氨氮)總量的檢測備受關注。利用氨氣傳感器檢測水體中氨氮含量的示意圖如下:
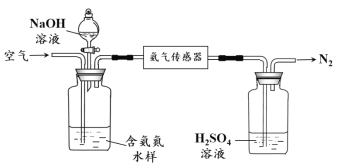
① 利用平衡原理分析含氨氮水樣中加入NaOH溶液的作用:_______________。
② 若利用氨氣傳感器將1 L水樣中的氨氮完全轉化為N2時,轉移電子的物質的量為6×10-4 mol,則水樣中氨氮(以氨氣計)含量為________mg·L-1。
(3)氨的轉化與去除。 微生物燃料電池(MFC)是一種現代化氨氮去除技術。下圖為MFC碳氮聯合同時去除的氮轉化系統原理示意圖。
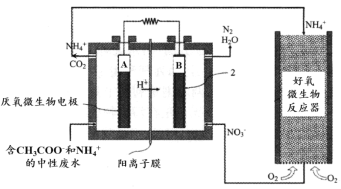
已知A、B兩極生成CO2和N2的物質的量之比為5 : 2,寫出A極的電極反應式:_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com