
【題目】氯化亞銅(CuCl)廣泛應用于冶金工業,也用作催化劑和殺菌劑。以硫化銅精礦為原料生產CuCl的工藝如下:
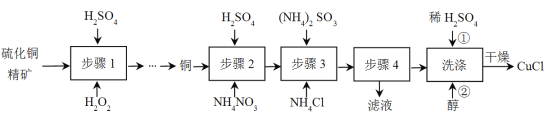
已知CuCl難溶于醇和水,溶于c(Cl-)較大的體系[CuCl(s)+Cl-![]() CuCl2-],潮濕空氣中易水解氧化。
CuCl2-],潮濕空氣中易水解氧化。
(1)步驟1開始前需要對硫化銅精礦進行粉碎,目的是______;
(2)步驟1是“氧化酸浸”的過程,該過程生成藍色溶液和淺黃色沉淀,化學方程式是__________________________________;
(3)步驟2是溶解過程,溶解時反應的離子方程式______;
(4)步驟3為主反應,Cu+的沉淀率與加入的NH4Cl的量關系如圖所示。
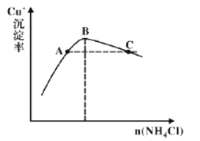
①反應的氧化產物是______;
②比較c(Cu+)相對大小:A點______C點(填“>”、“<”或“=”);
③提高C點狀態混合物中Cu+沉淀率的措施是______;
(5)步驟4進行的實驗操作是______;
(6)洗滌過程中不能用硝酸代替硫酸進行“酸洗”,理由是______。
【答案】增大接觸面積、加快反應速率、提高銅的浸出速率等合理性答案 CuS+H2SO4+H2O2=CuSO4+S+2H2O 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O或Cu+4H++2NO3-=Cu2++2NO2↑+2H2O SO42- 或(NH4)2SO4 > 加水稀釋 過濾 HNO3具有強氧化性會把CuCl氧化
【解析】
H2O2在酸性條件下將CuS中的S2-氧化生成S單質,其反應方程式為:CuS+H2SO4+H2O2=CuSO4+S+2H2O,CuSO4被還原生成Cu單質;利用NO3-在酸性條件下具有強氧化性,可氧化Cu單質生成Cu2+,然后過濾,濾液中加入(NH4)2SO3和NH4Cl發生氧化還原反應生成CuCl,其離子反應方程式為:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+,得到的CuCl經硫酸酸洗后再用乙醇洗滌,烘干得到CuCl。
(1)“氧化酸浸”前先將銅礦粉碎的目的是增大接觸面積,加快酸浸速率,提高銅的浸出率等,故答案為:增大接觸面積、加快反應速率、提高銅的浸出速率等合理性答案。
(2)該過程生成藍色溶液和淺黃色沉淀,說明生成硫酸銅和硫單質,H2O2在酸性條件下將CuS中的S2-氧化生成S單質,其反應的化學反應方程式為CuS+H2SO4+H2O2=CuSO4+S+2H2O,故答案為:CuS+H2SO4+H2O2=CuSO4+S+2H2O。
(3)“溶解”過程中,利用NO3-在酸性條件下具有強氧化性,可氧化Cu單質生成Cu2+,離子反應方程式為:3Cu+8H++2NO3-=3Cu2++
2NO↑+4H2O或Cu+4H++2NO3-=Cu2++2NO2↑+2H2O ,故答案為:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O或Cu+4H++2NO3-=Cu2++2NO2↑+2H2O 。
(4)①涉及反應為:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+,反應中S元素化合價由+4價升高為+6價,被氧化,氧化產物為SO42-或(NH4)2SO4,故答案為:SO42- 或(NH4)2SO4。
②B點之前Cu+與Cl-形成CuCl的沉淀,B點時建立了CuCl(s)![]() Cu+(aq)+Cl-(aq),B點之后,c(Cl-)增大,部分CuCl(s)溶解,[CuCl(s)+Cl-
Cu+(aq)+Cl-(aq),B點之后,c(Cl-)增大,部分CuCl(s)溶解,[CuCl(s)+Cl-![]() CuCl2-],但是平衡沒移動,所以C點和B點的c(Cu+)相等,由于B點之前,CuCl(s)
CuCl2-],但是平衡沒移動,所以C點和B點的c(Cu+)相等,由于B點之前,CuCl(s)![]() Cu+(aq)+Cl-(aq)平衡向右移動,所以A點c(Cu+)大于B點,則A點c(Cu+)大于C點,故答案為:>。
Cu+(aq)+Cl-(aq)平衡向右移動,所以A點c(Cu+)大于B點,則A點c(Cu+)大于C點,故答案為:>。
③B點之后,c(Cl-)增大,部分CuCl(s)溶解,發生[CuCl(s)+Cl-![]() CuCl2-],沉淀減少,所以提高C點狀態混合物中Cu+沉淀率,可以加水稀釋,減少c(Cl-),故答案為:加水稀釋。
CuCl2-],沉淀減少,所以提高C點狀態混合物中Cu+沉淀率,可以加水稀釋,減少c(Cl-),故答案為:加水稀釋。
(5)步驟4是固液分離,所以進行的實驗操作是過濾,故答案為:過濾。
(6)硝酸具有強氧化性,可氧化CuCl,則不能用硝酸代替硫酸,故答案為:HNO3具有強氧化性會把CuCl氧化。


 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案 目標測試系列答案
目標測試系列答案科目:高中化學 來源: 題型:
【題目】碘在科研與生活中有重要作用,某興趣小組用0.50molL-1 KI、0.2%淀粉溶液、0.20molL-1 K2S2O8、0.10molL-1 Na2S2O3等試劑,探究反應條件對化學反應速率的影響。
已知:S2O82-+2I-=2SO42-+I2(慢) I2+2S2O32-=2I-+S4O62-(快)
(1)向KI、Na2S2O3與淀粉的混合溶液中加入一定量的K2S2O8溶液,當溶液中的 耗盡后,溶液顏色將由無色變為藍色,為確保能觀察到藍色,S2O32-與S2O82-初始的物質的量需滿足的關系為:n(S2O32-):n(S2O82-) 。
(2)為探究反應物濃度對化學反應速率的影響,設計的實驗方案如下表:
實驗 | 體積V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx= mL,理由是 。
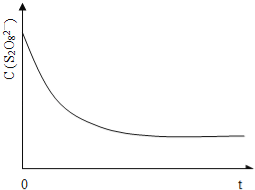
(3)已知某條件下,濃度c(S2O82-)~反應時間t的變化曲線如圖13,若保持其它條件不變,請在答題卡坐標圖中,分別畫出降低反應溫度和加入催化劑時c(S2O82-)~反應時間t的變化曲線示意圖(進行相應的標注)。
(4)碘也可用作心臟起捕器電源﹣鋰碘電池的材料,該電池反應為:2Li(s)+I2(s)=2LiI(s) △H
已知:4Li(s)+O2(g)=2Li2O(s) △H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s) △H2
則電池反應的△H= ;碘電極作為該電池的 極。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中可以說明2HI(g)![]() H2(g)+I2(g)已達到平衡狀態的是( )
H2(g)+I2(g)已達到平衡狀態的是( )
(1)單位時間內生成n mol H2的同時生成n mol HI
(2)一個H—H鍵斷裂的同時有兩個H—I鍵斷裂
(3)c(HI)= c(I2)
(4)反應速率υ(H2)=υ(I2)=0.5υ(HI)
(5)c(H2)∶c(I2)∶c(HI)=2∶1∶1
(6)溫度和體積一定時,某一生成物濃度不再變化
(7)溫度和體積一定時,容器內壓強不再變化
(8)條件一定,混合氣體的平均相對分子質量不再變化
(9)溫度和體積一定時,混合氣體的顏色不再發生變化
(10)溫度和壓強一定時,混合氣體的密度不再發生變化
A. (1)(2)(5)(9)(10) B. (2)(6)(9) C. (6)(7)(10) D. 全部
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化硫通入氯化鋇溶液中理論上不產生沉淀,而實際受到空氣和溶液中氧氣的影響很快便能觀察到沉淀現象。為了避免產生沉淀,某化學小組設計了如下實驗裝置,實驗操作步驟如下:

①氣密性檢査完好后,在裝置A中的多孔隔板上放上鋅粒,通過_______注入稀硫酸、打開活塞,將產生的氫氣導入到后續裝置。
②________后,關閉活塞,將裝置D的導管插入燒杯中。
③通過裝置B的________滴加濃硫酸,產生的氣體進入到BaCl2溶液中,溶液保持澄清。
④打開活塞,將產生的氫氣導入后續裝置一段時間。
⑤將盛有BaCl2溶液的試管從裝置中取出,拔去橡皮塞用膠頭滴管伸入到苯層下方滴加雙氧水,隨即出現白色渾濁,滴加稀鹽酸并振蕩,白色渾濁不消失。
⑥拆卸裝置,清洗儀器,處理剩余藥品。
請回答下列問題:
(1)實驗步驟①和③的空白處使用的儀器分別為__________、__________
(2)裝置C中苯的作用是__________。
(3)實驗步驟②的操作為__________。
(4)實驗步驟④的目的是__________。
(5)寫出實驗步驟⑤試管中發生反應的化學方程式:__________、____________。
(6)為了避免產生沉淀,你認為還應采取哪些措施?請舉一例:__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有效控制大氣溫室氣體濃度,推動綠色低碳發展,是人類可持續發展的重要戰略之一,因此捕集、利用CO2始終是科學研究的熱點。
(1)新的研究表明,可以將CO2轉化為炭黑回收利用,反應原理如圖所示。
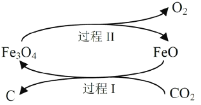
①碳在元素周期表中的位置是_______________。
②整個過程中FeO的作用是__________________。
③寫出CO2轉化為炭黑的總反應化學方程式__________________。
(2)我國科學家用Fe3(CO)12/ZSM-5催化CO2加氫合成低碳烯烴反應,所得產物含CH4、C3H6、C4H8等副產物,反應過程如圖。
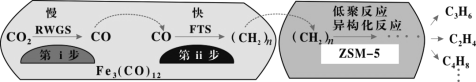
催化劑中添加Na、K、Cu助劑后(助劑也起催化作用)可改變反應的選擇性,在其他條件相同時,添加不同助劑,經過相同時間后測得CO2轉化率和各產物的物質的量分數如下表。
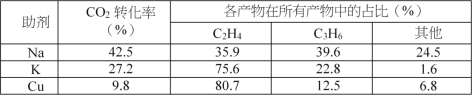
①欲提高單位時間內乙烯的產量,在Fe3(CO)12/ZSM-5中添加____________助劑效果最好;
②加入助劑能提高單位時間內乙烯產量的根本原因是____________。
(3)電解法轉化CO2可實現CO2資源化利用。電解CO2制HCOOH的原理如右圖所示。
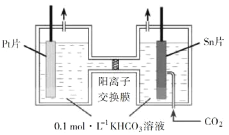
①寫出陰極CO2還原為HCOO的電極反應式:________________________。
②電解一段時間后,陽極區的KHCO3溶液濃度降低,其原因是_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氧燃料電池是符合綠色化學理念的新型發電裝置。下圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定。請回答:

(1)氫氧燃料電池的在導線中電流的方向為由______(用a、b表示)。
(2)負極反應式為______,正極反應式為___________。
(3)該電池工作時,H2和O2連續由外部供給,電池可連續不斷提供電能。因此,大量安全儲氫是關鍵技術之一。金屬鋰是一種重要的儲氫材料,吸氫和放氫原理如下:
Ⅰ 2Li+H2![]() 2LiH Ⅱ LiH+H2O=LiOH+H2↑
2LiH Ⅱ LiH+H2O=LiOH+H2↑
①反應Ⅰ中的還原劑是_________,反應Ⅱ中的氧化劑是_____。
②已知LiH固體密度為0.82g·cm-3,用鋰吸收224 L(標準狀況)H2,生成的LiH體積與被吸收的H2體積比為______。
③由②生成的LiH與H2O作用,放出的H2用作電池燃料,若能量轉化率為80%,則導線中通過電子的物質的量為___mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2016年IUPAC命名117號元素為Ts(中文名“![]() ”,tián),Ts的原子核外最外層電子數是7。下列說法不正確的是
”,tián),Ts的原子核外最外層電子數是7。下列說法不正確的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的電子數
C.Ts在同族元素中非金屬性最弱
D.中子數為176的Ts核素符號是![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下面有關晶體的敘述中,不正確的是
A. 氯化銫晶體中,每個Cs+周圍緊鄰8個Cl-
B. SiO2晶體為空間網狀結構,由共價鍵形成的原子環中,最小的環上有12個原子
C. 干冰晶體中,每個CO2分子周圍緊鄰12個CO2分子
D. 金屬銅屬于六方最密堆積結構,金屬鎂屬于面心立方最密堆積結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SO2是大氣中的有害物質,需要對其進行綜合治理和利用。
(1)工業上常用氨水吸收法處理SO2,可生成(NH4)2SO3或NH4HSO3。
① (NH4)2SO3顯堿性,用化學平衡原理解釋其原因:____________。
② NH4HSO3顯酸性。用氨水吸收SO2,當吸收液顯中性時,溶液中離子濃度關系正確的是____(填字母)。
a.c(NH4+)=2c(SO32-)+c(HSO3-)
b.c(NH4+)>c(SO32-)> c(H+)=c(OH-)
c.c(NH4+)+c(H+)=c(SO32-) +c(HSO3-)+c(OH-)
(2)某工廠煙氣中主要含SO2、CO2,在較高溫度經下圖所示方法脫除SO2,可制得H2SO4。
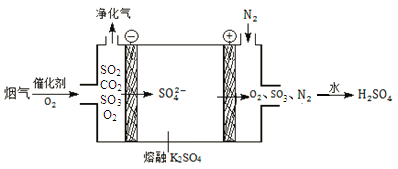
①在陰極放電的物質是_______。
②在陽極生成SO3的電極反應式是______。
(2)檢測煙氣中SO2脫除率的步驟如下:
a.將一定量的凈化氣(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
b.加入濃鹽酸,加熱溶液至無色無氣泡,再加入足量BaCl2溶液。
c.過濾、洗滌、干燥,稱量沉淀質量。
①用離子方程式表示a中溴水的主要作用________________。
②若沉淀的質量越大,說明SO2的脫除率越_____(填“高”或“低”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com