
【題目】某混合氣體由一種氣態烷烴和一種氣態烯烴(含一個雙鍵)組成,在同溫同壓下,混合氣體對氫氣的相對密度13,在標準狀況下,將56L混合氣體通入足量的溴水中,溴水的質量增重35g。
(1)計算確定混合氣體中烴的化學式_____。
(2)混合氣體中兩種烴的物質的量之比_____。
【答案】CH4、C4H8 3∶1
【解析】
(1)根據相對密度得出混合氣體的平均相對分子質量,混合氣體中必定有甲烷,利用混合氣體的總體積得出混合氣體的物質的量,算出混合氣體的總質量,加入溴水后,溴水的質量增加的的是烯烴的質量,即烯烴的質量是35g,甲烷的質量為65g-35g=31g,甲烷的總物質的量為![]() =1.875mol,設烯烴的分子式為CnH2n,利用烯烴的質量關系,(2.5mol-1.875mol)×14ng·mol-1=35g,可以算出n的值;
=1.875mol,設烯烴的分子式為CnH2n,利用烯烴的質量關系,(2.5mol-1.875mol)×14ng·mol-1=35g,可以算出n的值;
(2)根據分析可以得到甲烷與丁烯的物質的量之比。
(1)混合氣體的平均相對分子質量為13×2=26,必有甲烷,混合氣體的物質的量為![]() =2.5mol,混合氣體的質量為2.5 mol×26 g·mol-1=65g,甲烷的物質的量為
=2.5mol,混合氣體的質量為2.5 mol×26 g·mol-1=65g,甲烷的物質的量為![]() =1.875mol;設烯烴的分子式為CnH2n,(2.5mol-1.875mol)×14ng·mol-1=35g,解得n=4,化學式為C4H8;
=1.875mol;設烯烴的分子式為CnH2n,(2.5mol-1.875mol)×14ng·mol-1=35g,解得n=4,化學式為C4H8;
故答案為:CH4、C4H8;
(2)甲烷與丁烯的物質的量之比=1.875mol∶(2.5mol-1.875mol)=3∶1;
故答案為3∶1


科目:高中化學 來源: 題型:
【題目】一定溫度下,向3個初始體積均為1.0 L的密閉容器中按下表所示投料,發生反應N2(g)+3H2(g)![]() 2NH3(g) △H<0達到平衡,下列說法錯誤的是
2NH3(g) △H<0達到平衡,下列說法錯誤的是
容器編號 | 容器類型 | 起始物質的量/mol | 反應物的轉化率 | 平衡時NH3的物質的量/mol | ||
N2 | H2 | NH3 | ||||
Ⅰ | 恒溫恒容 | 1 | 3 | 0 | α1 | 1.2 |
Ⅱ | 絕熱恒容 | 1 | 3 | 0 | α2 | a |
Ⅲ | 恒溫恒壓 | 2 | 6 | 0 | α3 | b |
A. 達到平衡時,α1>α2
B. 平衡時NH3的物質的量b<2.4
C. 達到平衡時,容器Ⅱ中的反應速率比容器Ⅰ中的大
D. 保持溫度不變,向容器Ⅰ中再充入0.1mol N2、0.2mol H2、0.2 mol NH3,平衡向正反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知CrO42-和Cr2O72-在溶液中可相互轉化。室溫下,初始濃度為1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)隨c(H+)的變化如圖所示。

(1)用離子方程式表示Na2CrO4溶液中的轉化反應______。
(2)由圖可知,溶液酸性增大,CrO42-的平衡轉化率____(填“增大”“減小”或“不變”)。根據A點數據,計算出該轉化反應的平衡常數為________。
(3)升高溫度,溶液中CrO42-的平衡轉化率減小,則該反應的ΔH________0(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據預測,到2040年我國煤炭消費仍將占能源結構的三分之一左右。H2S在催化活性碳(AC)表面的遷移,對煤的清潔和綜合應用起了很大的促進作用,其機理如圖所示,其中ad表示物種的吸附狀態。下列有關敘述錯誤的是

A.圖中陰影部分表示H2S分子的吸附與離解
B.AC表面作用的溫度不同,H2S的去除率不同
C.H2S在AC表面作用生成的產物有H2O、H2、S、SO2、CS2等
D.圖中反應過程中只有H—S鍵的斷裂,沒有H—S鍵的形成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生產醫用防護口罩的原料聚丙烯纖維屬于有機高分子材料,其單體為丙烯。丙烯除了合成聚丙烯外,還廣泛用于制備1,2—二氯丙烷、丙烯醛、丙烯酸等。請回答下列問題:
Ⅰ.工業上用丙烯加成法制備1,2—二氯丙烷,主要副產物為3—氯丙烯,反應原理為:
①![]()
![]()
②![]()
![]()
(1)已知![]() 的活化能
的活化能![]() (逆)為
(逆)為![]() ,則該反應的
,則該反應的![]() (正)活化能為_____
(正)活化能為_____![]() 。
。
(2)一定溫度下,向恒容密閉容器中充入等物質的量的![]() 和
和![]() ,在催化劑作用下發生反應①②,容器內氣體的壓強隨時間的變化如下表所示。
,在催化劑作用下發生反應①②,容器內氣體的壓強隨時間的變化如下表所示。
時間/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
壓強/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
用單位時間內氣體分壓的變化來表示反應速率,即![]() ,則反應①前180min內平均反應速率
,則反應①前180min內平均反應速率![]() ____
____![]() (保留小數點后2位)。
(保留小數點后2位)。
Ⅱ.丙烯的制備方法
方法一:丙烷無氧脫氫法制備丙烯反應如下:
![]()
![]()
(3)①某溫度下,在剛性容器中充入![]() ,起始壓強為10kPa,平衡時總壓為14kPa,
,起始壓強為10kPa,平衡時總壓為14kPa,![]() 的平衡轉化率為______。該反應的平衡常數
的平衡轉化率為______。該反應的平衡常數![]() ______kPa(保留小數點后2位)。
______kPa(保留小數點后2位)。
②總壓分別為100kPa、10kPa時發生該反應,平衡體系中![]() 和
和![]() 的物質的量分數隨溫度變化關系如圖所示:
的物質的量分數隨溫度變化關系如圖所示:
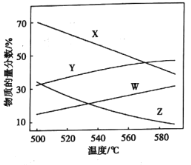
10kPa時,![]() 和
和![]() 的物質的量分數隨溫度變化關系的曲線分別是_____、______。
的物質的量分數隨溫度變化關系的曲線分別是_____、______。
方法二:丙烷氧化脫氫法制備丙烯還生成![]() 、
、![]() 等副產物,制備丙烯的反應如下:
等副產物,制備丙烯的反應如下:
![]()
![]() 。在催化劑作用下
。在催化劑作用下![]() 的轉化率和
的轉化率和![]() 的產率隨溫度變化關系如圖所示。
的產率隨溫度變化關系如圖所示。
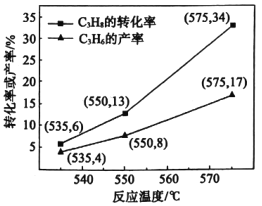
(4)①圖中![]() 的轉化率隨溫度升高而上升的原因是_________。
的轉化率隨溫度升高而上升的原因是_________。
②575℃時,![]() 的選擇性為___。(
的選擇性為___。(![]() 的選擇性=
的選擇性=![]() )
)
③基于上述研究結果,能提高![]() 選擇性的措施是______。
選擇性的措施是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列三個化學反應的平衡常數(K1、K2、K3)與溫度的關系分別如表所示:
化學反應 | 平衡常數 | 溫度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
下列說法正確的是
A.ΔH1<0,ΔH2>0
B.反應①②③的反應熱滿足關系:ΔH1-ΔH2=ΔH3
C.反應①②③的平衡常數滿足關系:K1·K2=K3
D.要使反應③在一定條件下建立的平衡向正反應方向移動,可采取降溫措施
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量的X加入某密閉容器中,發生反應:2X(g)![]() 3Y(g)+Z(g),混合氣體中X的物質的量分數與溫度關系如圖所示:下列推斷正確的是()。
3Y(g)+Z(g),混合氣體中X的物質的量分數與溫度關系如圖所示:下列推斷正確的是()。
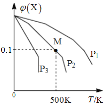
A. 升高溫度,該反應平衡常數K減小
B. 壓強大小有P3>P2>P1
C. 平衡后加入高效催化劑使平均摩爾質量增大
D. 在該條件下M點X平衡轉化率為9/11
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:![]() 。室溫下,向濃度為0.1mol·L-1的氨水中緩緩通入HCl,
。室溫下,向濃度為0.1mol·L-1的氨水中緩緩通入HCl,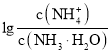 隨pOH的變化曲線如下圖所示。假設溶液體積沒有變化,下列推斷正確的是( )
隨pOH的變化曲線如下圖所示。假設溶液體積沒有變化,下列推斷正確的是( )
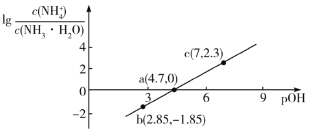
A.NH3·H2O的電離常數的數量級為10-4
B.b點溶液中:![]()
C.c點溶液中:![]()
D.pOH=8的溶液中:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以氯酸鈉(NaClO3)等為原料制備亞氯酸鈉(NaClO2)的工藝流程如下,下列說法中,不正確的是
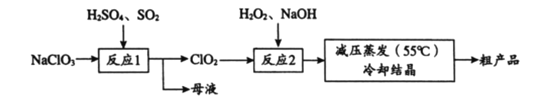
A. 反應1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 從母液中可以提取Na2SO4
C. 反應2中,H2O2做氧化劑
D. 采用減壓蒸發可能是為了防止NaClO2受熱分解
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com