
【題目】(1)同溫同壓下,![]() 與
與![]() (均為氣體),它們的體積之比為_____________,它們的質量之比為_____________。
(均為氣體),它們的體積之比為_____________,它們的質量之比為_____________。
(2)3.80g![]() 含有0.08mol
含有0.08mol![]() ,
,![]() 的摩爾質量為_____________,若M原子中質子數與中子數相等,該物質的化學式為_____________。
的摩爾質量為_____________,若M原子中質子數與中子數相等,該物質的化學式為_____________。
(3)某化學社團的同學對僅由兩種元素組成的化合物X進行研究,實驗過程形成如圖示:
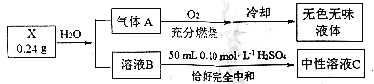
已知:A為單質,B的焰色反應只顯示黃色。
寫出X與水反應的化學方程式_______________________________________。
【答案】2:3 1:1 ![]() MgCl2
MgCl2 ![]()
【解析】
(1)同溫同壓下,氣體的摩爾體積相同,根據m=nM進行計算比較;
(2)摩爾質量=![]() ;質子數+中子數=質量數;
;質子數+中子數=質量數;
(3)B的焰色反應只顯示黃色說明含有Na元素,能與50mL0.1mol/L的硫酸溶液恰好中和說明B溶液顯堿性;氣體A在氧氣中燃燒生成無色無味液體,可推測A為氫氣,所以X所含的兩種元素為H和Na,可先猜測其化學式為NaH,則 0.24gNaH的物質的量為![]() ,生成的B溶液為氫氧化鈉,氫氧化鈉的物質的量為0.01mol,50mL0.1mol/L的硫酸溶液中氫離子物質的量為0.01mol,恰好與氫氧化鈉完全反應,符合題意,即猜想成立,X為NaH。
,生成的B溶液為氫氧化鈉,氫氧化鈉的物質的量為0.01mol,50mL0.1mol/L的硫酸溶液中氫離子物質的量為0.01mol,恰好與氫氧化鈉完全反應,符合題意,即猜想成立,X為NaH。
(1)同溫同壓下,氣體的摩爾體積相同,所以體積之比等于物質的量之比,![]() 與
與![]() (均為氣體),它們的體積之比為0.4:0.6=2:3;
(均為氣體),它們的體積之比為0.4:0.6=2:3;![]() 的質量為0.4mol×48g/mol=19.2g,
的質量為0.4mol×48g/mol=19.2g,![]() 的質量為0.6mol×32g/mol=19.2g它們的質量之比為1:1。
的質量為0.6mol×32g/mol=19.2g它們的質量之比為1:1。
(2)3.80g![]() 含有0.08mol
含有0.08mol![]() ,則
,則![]() 的物質的量為0.04mol,
的物質的量為0.04mol,![]() 的摩爾質量=
的摩爾質量=![]() ,M的質量數為95-35.5×2=24,M原子中質子數與中子數相等,質量數=質子數+中子數,所以該原子的質子數為12,即Mg,所以物質的化學式為MgCl2;
,M的質量數為95-35.5×2=24,M原子中質子數與中子數相等,質量數=質子數+中子數,所以該原子的質子數為12,即Mg,所以物質的化學式為MgCl2;
(3)根據分析可知X為NaH,其與水反應生成氫氧化鈉和氫氣,方程式為:![]() 。
。


科目:高中化學 來源: 題型:
【題目】下列依據熱化學方程式得出的結論正確的是
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)為放熱反應,則SO2的能量一定高于SO3的能量
2SO3(g)為放熱反應,則SO2的能量一定高于SO3的能量
B. 若C(石墨,s)=C(金剛石,s) ΔH>0,則石墨比金剛石穩定
C. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,則20.0 g NaOH固體與稀鹽酸完全中和,放出28.7 kJ的熱量
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,則ΔH1>ΔH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、U、W五種短周期非金屬元素,它們的原子半徑與原子序數有如圖關系,化合物XZ是水煤氣的主要成分之一,下列說法不正確的是( )
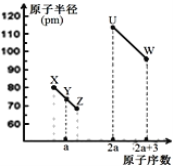
A.U、X、W三種元素最高價含氧酸酸性依次增強
B.由Y、Z和氫三種元素形成的化合物中一定只含共價鍵
C.XZ2與X60的化學鍵類型和晶體類型都相同
D.1molU的氧化物中含4NA個共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)請寫出指定物質對應的化學式。消毒劑碘伏中含有碘分子_____________,膠卷中必不可少的感光材料_____________,加碘鹽中含有碘酸鉀_____________,發酵粉含有小蘇打_____________。
(2)化工廠鎂著火,不能用二氧化碳滅火,用化學方程式解釋__________________________。
(3)電解飽和食鹽水是氯堿工業的基礎,寫出化學方程式__________________________。
(4)稀醋酸處理熱水瓶中水垢(主要成分為碳酸鈣)的離子方程式__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol,則![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)的ΔH為( )
Cl2(g)=HCl(g)的ΔH為( )
A.+184.6kJ/molB.-92.3kJ/molC.-369.2kJ/molD.+92.3kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉻及其化合物在材料、顏料及超導等方面用途非常廣泛。回答下列問題:
(1)基態Cr原子的價電子排布式為__;Cr成為陽離子時首先失去__軌道的電子。
(2)鉻與鉀均位于第四周期,鉻的熔點和沸點均比鉀的高,這是因為__。
(3)甘氨酸鉻(結構如圖)是一種配合物,其配位原子是__。
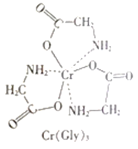
(4)反應:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四種組成元素中第一電離能最大的是__(填元素符號);KSCN中陰離子的空間構型為___形,中心原子的雜化方式是__。
②分子中的大![]() 鍵可用符號
鍵可用符號![]() 表示,其中m代表參與形成大
表示,其中m代表參與形成大![]() 鍵的原子數,n代表參與形成大
鍵的原子數,n代表參與形成大![]() 鍵的電子數(如苯分子中的大
鍵的電子數(如苯分子中的大![]() 鍵可表示為
鍵可表示為![]() ),則NO2的大
),則NO2的大![]() 鍵可表示為__。
鍵可表示為__。
(5)立方CrO2晶體的結構如圖所示,晶胞參數為apm。
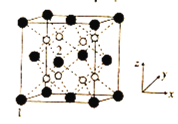
①設NA為阿伏加德羅常數的值,則CrO2的密度為__(列出計算式)g·cm-3。
②1、2號原子的坐標依次為(0,0,0)、(![]() ,0,
,0,![]() ),則原子坐標為(
),則原子坐標為(![]() ,
,![]() ,
,![]() )和(
)和(![]() ,
,![]() ,
,![]() )間的距離為__pm。
)間的距離為__pm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為確定乙醇分子(C2H6O)中活潑氫原子個數,采用下列裝置,通過測定乙醇與金屬鈉反應放出氫氣的多少進行計算。
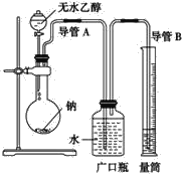
(1)指出實驗裝置中的錯誤:__。
(2)若實驗中用含有少量水的乙醇代替相同質量的無水乙醇,相同條件下,測得氫氣的體積將__(填“偏大”、“偏小”或“不變”)。
(3)請指出能使實驗安全、順利進行的關鍵實驗步驟(至少指出兩個關鍵步驟)__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】9.5 g含雜質的MgCl2溶于水,加足量的AgNO3溶液,得到28 g沉淀。若只含有一種雜質,則雜質不可能是( )
A.NaCl
B.AlCl3
C.CaCl2
D.FeCl3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將32.64 g銅與140 mL一定濃度的硝酸反應,銅完全溶解,產生的NO和NO2混合氣體在標準狀況下的體積為11.2 L。請回答下列問題:
(1)NO的體積為________L,NO2的體積為________L。
(2)參加反應的HNO3的物質的量是________。
(3)待產生的氣體全部釋放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部轉化成沉淀,則原硝酸溶液的濃度為________mol·L-1。
(4)欲使銅與硝酸反應生成的氣體在NaOH溶液中全部轉化為NaNO3,至少需要30%的雙氧水________g。
(5)欲使銅與硝酸反應生成的氣體在NaOH溶液中全部轉化為NaNO3,至少需要通O2______mol。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com