
【題目】二氧化氮在火箭燃料中可用作氧化劑,在亞硝基法生嚴流酸甲可用作催化劑,但直接將二氧化氮排放會造成環境污染。已知反應CH4(g) +2NO2(g)![]() N2(g) +CO2(g) + 2H2O(g) ,起始時向體積為V的恒容密閉容器中通人2mol CH4和3mol NO2,測得CH4.、N2、H2O的物質的量濃度與時間的關系如圖所示。
N2(g) +CO2(g) + 2H2O(g) ,起始時向體積為V的恒容密閉容器中通人2mol CH4和3mol NO2,測得CH4.、N2、H2O的物質的量濃度與時間的關系如圖所示。

(1)容器體積V=_______L。
(2)圖中表示H2O的物質的量濃度與時間關系的是曲線___________. (填“甲”“乙"或"丙")。
(3)0 ~5min內,用N2表示的化學反應速率為____________________mol·L-1·min-1。
(4)a、b、c三點中達到平衡的點是______。 達到平衡時, NO2的轉化率是___________ (物質平衡轉化=轉化的物質的量/起始的物質的量×100%)。
(5)a點時,c(CO2) =__________mol·L-1(保留兩位小數) ,n( CH4):n(NO2) =_________________。
【答案】2 甲 0.1 c 80% 或0.8 0.33 4:5
【解析】
依據圖像,根據反應物、生成物反應前后物質的量變化之比等于物質的量之比確定甲、乙、丙三條曲線分別代表CH4.、N2、H2O中的哪種物質;依據單位時間內濃度的變化,計算出0 ~5min內,用N2表示的化學反應速率;達到平衡時的判斷依據。
(1)起始時向體積為V的恒容密閉容器中通人2 mol CH4和3 mol NO2,測得CH4.、N2、H2O的物質的量濃度與時間的關系如圖所示,CH4是反應物,即起始時的物質的量濃度為1.0mol·L-1,依據c=![]() ,得V=
,得V=![]() =
=![]() =2L;
=2L;
(2)由(1)可知,丙代表CH4,從開始到平衡時,甲代表的物質的物質的量濃度增加量:1.2mol·L-1,乙代表的物質的物質的量濃度增加量:0.6mol·L-1,故從開始到平衡時,甲代表的物質的物質的量濃度增加量:1.2mol·L-1×2L=2.4mol;故從開始到平衡時,乙代表的物質的物質的量濃度增加量:0.6mol·L-1×2L=1.2mol,根據反應物、生成物反應前后物質的量變化之比等于物質的量之比,故甲代表H2O的物質的量濃度與時間關系,乙代表N2的物質的量濃度與時間關系;
(3)乙代表N2的物質的量濃度與時間關系,0 ~5 min內,N2的物質的量濃度變化量為:0.5mol·L-1 - 0=0.5mol·L-1,v(N2)=![]() =0.1mol·L-1·min -1;
=0.1mol·L-1·min -1;
(4)當達到平衡時反應物、生成物的濃度不再隨著時間的變化而變化,故a、b、c三點中達到平衡的點是c;達到平衡時,c(N2)=0.6mol·L-1,即從開始平衡,N2的物質的量增加了:0.6mol·L-1×2L=1.2mol,CH4(g) +2NO2(g)![]() N2(g) +CO2(g) + 2H2O(g) ,依據方程式中反應物、生成物的物質的量的變化量之比等于化學計量數之比,即從開始到平衡,NO2的物質的量變化量為:1.2mol×2=2.4mol,故達到平衡時, NO2的轉化率是
N2(g) +CO2(g) + 2H2O(g) ,依據方程式中反應物、生成物的物質的量的變化量之比等于化學計量數之比,即從開始到平衡,NO2的物質的量變化量為:1.2mol×2=2.4mol,故達到平衡時, NO2的轉化率是![]() =80%;
=80%;
(5)設a點時的濃度為xmol·L-1,CH4(g) +2NO2(g)![]() N2(g) +CO2(g) + 2H2O(g) ,依據方程式中反應物、生成物的物質的量的變化量之比等于化學計量數之比,(1.0-x):x=1:2,x=0.67,
N2(g) +CO2(g) + 2H2O(g) ,依據方程式中反應物、生成物的物質的量的變化量之比等于化學計量數之比,(1.0-x):x=1:2,x=0.67,![]() =0.67mol·L-1×2L=1.34mol,
=0.67mol·L-1×2L=1.34mol,![]() =1:2:1:1:2,a點時,
=1:2:1:1:2,a點時,![]() =0.67mol,c(CO2) =
=0.67mol,c(CO2) =![]() =0.33mol·L-1;
=0.33mol·L-1;![]() =0.67mol,
=0.67mol,![]() =1.34mol,故a點時,n( CH4):n(NO2)=(2mol-0.67mol):(3mol-1.34mol)=4:5。
=1.34mol,故a點時,n( CH4):n(NO2)=(2mol-0.67mol):(3mol-1.34mol)=4:5。


 時刻準備著暑假作業原子能出版社系列答案
時刻準備著暑假作業原子能出版社系列答案 暑假銜接教材期末暑假預習武漢出版社系列答案
暑假銜接教材期末暑假預習武漢出版社系列答案 假期作業暑假成長樂園新疆青少年出版社系列答案
假期作業暑假成長樂園新疆青少年出版社系列答案科目:高中化學 來源: 題型:
【題目】(1)12.4g Na2X含有0.4mol Na+,Na2X的摩爾質量為_____,X的相對原子質量為_____。
(2)相同狀況下,一定體積的氣態氫化物H2X的質量是等體積NH3的2倍.則X的相對原子質量為_____。
(3)0.05mol 的硫酸鈉中含有_____個氧原子;與_____g NaCl中所含有的Na+數目相同.
(4)氣態化合物A的化學式可以表示為OxFy,已知同溫同壓下10mLA受熱完全分解生成15mLO2和10mL F2,則A的化學式為_____。
(5)0.5L 0.5mol/L FeCl3溶液中的Cl﹣的物質的量濃度為_____。
(6)質量分數為98%,密度為1.84g.cm﹣3的某濃硫酸,溶質的物質的量濃度為_____。
(7)a個X原子的總質量為b g,則X的相對原子質量可表示為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下列各組化合物中,化學鍵類型和化合物類型均相同的是_________(填序號)。
A.CaCl2和 Na2S B.Na2O 和 Na2O2
C.CO2和CaO D.HC1 和 NaOH
(2)已知1 mol石墨轉化為1 mol金剛石要吸收能量,則1 mol石墨的能量比1 mol金剛石的能量____(填“高”或“低”),石墨比金剛石_______(填“穩定”或“不穩定”)。
(3)Ba(OH)2 8H2O和NH4Cl反應的化學方程式是____________,該反應是___(填“吸熱”或“放熱”)反應,反應過程能量變化的圖像符合_____________(填“圖1”或“圖2”)。
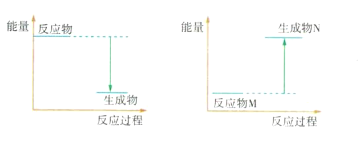
圖1 圖2
(4)如圖3所示,把試管放入盛有飽和澄清石灰水(溫度為25℃)的燒杯中,先在試管中放入幾小塊鎂片,再用滴管滴入5mL鹽酸。可以觀察到燒杯中的石灰水逐漸由澄清變渾濁,出現這種現象的原因是___________________________。
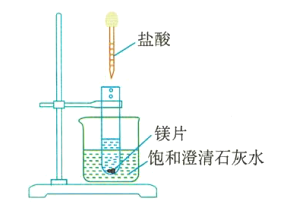
圖3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】德國核物理研究所的科學家實驗發現,植物和落葉都能產生甲烷,其生成隨著溫度和日照的增強而增加。甲烷(CH4 )在足量O2中完全燃燒產生CO2和H2O(g) ,該反應中各物質所含化學鍵鍵能如圖所示(鍵能是氣態基態原子形成1 mol化學鍵釋放的最低能量,單位為kJ·mol 1)。下列說法錯誤的是

A.甲烷在氧氣中燃燒的反應為放熱反應
B.O=O鍵的鍵能比C=O鍵的鍵能小
C.1 mol甲烷在足量氧氣中燃燒產生的H2O(g)所含化學鍵的能量為1856 kJ
D.1 mol CH4所含化學鍵的能量比1 mol CO2所含化學鍵的能量小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組設計的制取溴苯的實驗裝置如下圖所示:

裝置A是酸式滴定管,分液漏斗中是苯和液溴的混合物,打開分液漏斗的活塞,使混合物滴在鐵絲上(酸式滴定管活塞關閉)。請回答下列問題:
(1)A選用酸式滴定管而不用堿式滴定管的原因是___________________。
(2)A中反應的化學方程式是________________。
(3)垂直于A的導氣管要做得長一些,是為了_________________。
(4)實驗結束時,打開A下端的活塞,讓反應液流入B中,充分振蕩,目的是______________,反應的化學方程式是___________________。
(5)C中盛放四氯化碳的作用是_______________。
(6)能證明苯和液溴發生的是取代反應,而不是加成反應,可向試管D中加入硝酸銀溶液,若產生淡黃色沉淀,則能證明。另一種驗證的方法是向試管D中加入_____________,現象是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2016 年,《Nature》期刊報道一例CH3OH-O2在聚合物催化下的原電池,其工作示意圖如下。下列說法正確的是
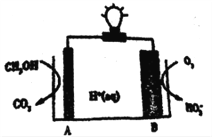
A. 電極B的電極反應為:O2+2e-+H+=HO2- B. 電解質溶液中H+由電極B流向A極
C. 電極A是負極,發生還原反應 D. 外電路中通過3mol電子,生成CO211.2 L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某含有Na2O雜質的Na2O2試樣,一個化學實驗小組利用H2O與Na2O2的反應來測定該樣品的純度。可供選擇的裝置如下:

請回答下列問題:
(1)裝置⑤中儀器a的名稱是______。
(2)用上述裝置可以組裝一套最簡單的測定過氧化鈉樣品純度的實驗裝置。
Ⅰ.該實驗裝置的組合是________(填字母)。
a. ①④⑤ b. ①③⑤ c. ②④⑤ d. ③⑤⑥
Ⅱ.所選用裝置的連接順序應是__________(填各接口的字母,連接膠管省略)。
(3)寫出實驗中Na2O2發生反應的化學方程式_____________。
(4)用上述實驗后所得溶液配制成濃度為1.0mol/L的溶液,回答下列問題。
①向400mL該溶液中通入0.3mol CO2,則所得溶液中HCO3–和CO32–的物質的量濃度之比約為___________。
A. 1:3 B. 1:2 C. 2:1 D. 3:1
②將上述溶液蒸發結晶得到Na2CO3和NaHCO3固體混合物,下列選項中不能準確測定混合物中Na2CO3質量分數的是____________。
a. 取a g混合物充分加熱,在干燥器中冷卻至室溫,減重b g
b. 取a g混合物與足量稀鹽酸充分反應,加熱、蒸干、灼燒,得b g固體
c. 取a g混合物與足量稀硫酸充分反應,逸出氣體用堿石灰吸收,增重b g
d. 取a g混合物與足量Ba(OH)2溶液充分反應,過濾、洗滌、烘干,得b g固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學將鐵鋁合金樣品溶解后取樣 25.00 mL,分離并測定Fe3+的濃度,實驗方案設計如下:

已知:乙醚[(C2H5)2O] 沸點為 34.5℃,易揮發、易燃,不純時點燃易發生爆炸,微溶于水,密度比水小。在鹽酸濃度較高時,Fe3+與 HCl、乙醚形成化合物[(CH3 ) OH][FeCl ]而溶于乙醚;當鹽酸濃度降低時,該化合物解離。請回答:
(1)操作A 得到溶液Ⅰ,具體操作是:靜置后,_____________________________。
(2)經操作 A 后,為判斷Fe3+是否有殘留,請設計實驗方案__________。
(3)蒸餾裝置如圖所示,裝置中存在的錯誤是____________、______________。

(4)下列有關說法正確的是__________。
A.為了減少滴定誤差,滴定管、錐形瓶均需用待裝液潤洗
B.標準KMnO4溶液應該裝在酸式滴定管中
C.開始滴定前,滴定管標準液內有氣泡,滴定終點時,氣泡消失了,則測得Fe3+的濃度偏低
D.三次平行測定時,每次需將滴定管中的液面調至“0”刻度或“0”刻度以下的附近位置
(5)用 0.1000 mol·L-1 KMnO 4溶液進行滴定,平行 實驗三次,達到終點時,平均消耗KMnO4溶液 6.00 mL (滴定前先除去溶液中溶解的 HCl)。根據該實驗數據,試樣 X 中c(Fe3+)為____________。(結果保留三位有效數字)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵電池是一種新型可充電電池,與普通高能電池相比,該電池能長時間保持穩定的放電電壓,高鐵電池的總反為:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列敘述不正確的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列敘述不正確的是( )
A. 放電時負極反應式為:Zn-2eˉ+2OHˉ=Zn(OH)2
B. 放電時每轉移3mol電子,正極有1 mol K2FeO4被還原
C. 放電時正極反應式為:Fe(OH)3-3eˉ+5OHˉ=FeO42-+4H2O
D. 放電時正極附近溶液的堿性增強
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com