
【題目】氯化亞銅(CuCl)是一種應用較廣的催化劑,有關物質的轉化關系如下圖所示(除B、E外,均為對應物質的溶液參加反應,部分生成物和反應條件已略去)。其中B為氣體,能使品紅溶液褪色;C為正鹽,D為重要的調味劑,E為一種紅色的金屬氧化物,M的摩爾質量為34gmol-1,它的水溶液常作醫用消毒液。

(1)E的化學式________________________。
(2)N的電子式為________________________。
(3)寫出反應①的化學方程式:_________________________________________。
(4)寫出反應②的離子方程式:_________________________________________。
【答案】Cu2O ![]() SO2+H2O2=H2SO4 2Cu2++SO32-+2Cl-+H2O
SO2+H2O2=H2SO4 2Cu2++SO32-+2Cl-+H2O![]() 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
【解析】
根據物質的特殊性質進行正向和逆向的推斷反應過程;根據氧化還原反應的概念進行配平書寫化學或離子反應方程式。
根據提示可知,其中B為氣體,能使品紅溶液褪色,則B是SO2, D為重要的調味劑,則D是NaCl,電解NaCl水溶液得到NaOH,則N是NaOH,NaOH和SO2反應生成的正鹽是Na2SO3,則C是Na2SO3,E為一種紅色的金屬氧化物,則E是Cu2O,M的摩爾質量為34gmol-1,它的水溶液常作醫用消毒液,則M是H2O2,反應①即為雙氧水與二氧化硫反應生成硫酸,方程式為:SO2+H2O2=H2SO4,硫酸與Cu2O在加熱的條件下反應生成硫酸銅、二氧化硫和水,反應②是硫酸銅與氯化鈉、亞硫酸鈉反應生成氯化亞銅,離子方程式為:2Cu2++SO32-+2Cl-+H2O![]() 2CuCl↓+SO42-+2H+,
2CuCl↓+SO42-+2H+,
故答案為:Cu2O;![]() ;SO2+H2O2=H2SO4;2Cu2++SO32-+2Cl-+H2O
;SO2+H2O2=H2SO4;2Cu2++SO32-+2Cl-+H2O![]() 2CuCl↓+SO42-+2H+;
2CuCl↓+SO42-+2H+;


 培優口算題卡系列答案
培優口算題卡系列答案 開心口算題卡系列答案
開心口算題卡系列答案 口算題卡河北少年兒童出版社系列答案
口算題卡河北少年兒童出版社系列答案科目:高中化學 來源: 題型:
【題目】愛國實業家侯德榜在氨堿法的基礎上,發明了“聯合制堿法”,簡單流程如圖。完成下列問題:

(1)在飽和食鹽水中通入X和Y,則X____(填物質名稱)
(2)寫出通入X和Y的化學反應方程式_____。
(3)操作Z____(填名稱),為了得到化肥(NH4Cl),需要在溶液B中通入NH3、加食鹽,其中通入NH3的作用一____,作用二____。
(4)工業生產的純堿常會含少量NaCl雜質。現用重量法測定其純度,步驟如下:①稱取樣品ag,加水溶解;②加入足量的BaCl2溶液;③過濾、___、烘干、冷卻、稱量、烘干、冷卻、___,最終得到固體bg。樣品中純堿的質量分數為____(用含a、b的代數式)
(5)某課外活動小組要用NaOH溶液和CO2來制備Na2CO3固體,他們只有未知濃度的NaOH溶液50毫升和足量的CO2,他們的設計方案是:首先_____,然后_____,加熱_____后,再____,最后加熱濃縮,冷卻結晶,過濾得固體Na2CO3 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘在地殼中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,幾種微粒之間的轉化關系如圖所示。已知:淀粉遇單質碘變藍。下列說法中,不正確的是
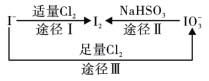
A. 氧化性的強弱順序為:Cl2 >IO3- >I2
B. 一定條件下, I-與IO3-反應可能生成I2
C. 途徑Ⅱ中若生成1mol I2,消耗4mol NaHSO3
D. 向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液不一定變為藍色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】離子交換法淡化海水的實驗裝置如圖所示,下列說法正確的是

A. 通過HR樹脂后,溶液中的離子數目和溶液的導電能力不變
B. HR樹脂與ZOH樹脂的位置可交換
C. 通過HR樹脂時,溶液中有離子反應H++OH-═H2O發生
D. 工作一段時間后,兩種樹脂均需進行再生處理
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素W、X、Y、Z的原子序數依次增大,W、Z位于同主族,四種元素組成的一種化合物的結構式為 。下列說法不正確的是
。下列說法不正確的是
A. W的最簡單氫化物的穩定性比X的弱
B. X.Y形成的化合物水溶液顯堿性
C. W與Y形成的化合物中一定含有離子鍵
D. 原子半徑:Y>Z>X>W
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I、在火箭推進器中裝有強還原劑肼(N2H4)和強氧化劑(H2O2),當它們混合時,即產生大量![]() N2和水蒸氣,并放出大量熱.已知0.4mol液態肼和足量液態H2O2反應,生成氮氣和水蒸氣,放出256kJ的熱量.
N2和水蒸氣,并放出大量熱.已知0.4mol液態肼和足量液態H2O2反應,生成氮氣和水蒸氣,放出256kJ的熱量.
(1)寫出該反應的熱化學方程式_______________________________________.
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,則16g液態肼燃燒生成氮氣和液態水時,放出的熱量是________kJ.
(3)丙烷燃燒可以通過以下兩種途徑:
途徑I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1
途徑II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1
2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均為正值)
請回答下列問題:
①判斷等量的丙烷通過兩種途徑放出的熱量,途徑I放出的熱量_______(填“大于”、“等于”或“小于”)途徑II放出的熱量.
②在C3H8(g)═C3H6(g)+H2(g) 的反應中,反應物具有的總能量________(填“大于”、“等于”或“小于”)生成物具有的總能量.
③b 與a、c、d的數學關系式是_____________.
II、利用如圖所示裝置測定中和熱的實驗步驟如下:

①用量筒量取50 mL 0.50 mol·L1鹽酸倒入小燒杯中,測出鹽酸溫度;②用另一量筒量取50 mL 0.55 mol·L1 NaOH溶液,并用同一溫度計測出其溫度;③將NaOH溶液倒入小燒杯中,設法使之混合均勻,測得混合液最高溫度。
回答下列問題:
(1)為什么所用NaOH溶液要稍過量?__________________________。
(2)假設鹽酸和氫氧化鈉溶液的密度都是1 g·cm3,又知中和反應后生成溶液的比熱容c=4.18 J·g1·℃1。為了計算中和熱,某學生實驗記錄數據如下:
實驗 序號 | 起始溫度t1/℃ | 終止溫度t2/℃ | |
鹽酸 | 氫氧化鈉 | ||
1 | 20.0 | 20.0 | 23.0 |
2 | 20.1 | 20.1 | 23.2 |
3 | 20.2 | 20.2 | 23.4 |
依據該學生的實驗數據計算,該實驗測得的中和熱ΔH=________kJ·mol1_(結果保留一位小數)。
(3)不能用Ba(OH)2溶液和硫酸代替氫氧化鈉溶液和鹽酸,理由是_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是部分短周期元素化合價與原子序數的關系圖,下列說法正確的是( )

A.原子半徑:Z>Y>X
B.Y和Z兩者最高價氧化物對應的水化物能相互反應
C.氣態氫化物的穩定性:R<W
D.WX3和水反應形成的化合物是離子化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原兒茶醛是一種醫藥中間體,一種合成路線如圖:

已知:①D能與FeCl3溶液發生顯色反應,E與FeCl3溶液不發生顯色反應;
②G能發生銀鏡反應;
③苯酚在多聚甲醛和氯化氫作用下,在鄰位或對位發生取代反應。
回答下列問題:
(1)A中的官能團名稱是____。
(2)碳原子上連有4個不同的原子或基團時,該碳稱為手性碳。在B的結構簡式中用星號(*)標出B中的手性碳:____。
(3)反應①的類型是_____;反應②所需的試劑和條件是_____。
(4)寫出D到E反應的化學方程式:______。
(5)G的結構簡式是____。
(6)W與C互為同分異構體,W中不含環狀結構,能發生水解反應,核磁共振氫譜只有3組峰且峰面積之比為6:3:1,W的結構簡式為_____(只寫一種)。
(7)設計以苯酚和(CH2O)n為原料制備 的合成路線。(無機試劑任選)____
的合成路線。(無機試劑任選)____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】重鉻酸鉀(K2Cr2O7)是一種強氧化劑,可用于檢測酒駕中酒精的含量,電化學制備K2Cr2O7的裝置如圖所示,其中a、b均為石墨電極。下列說法正確的是

A. X是電源的正極
B. 電解過程中K+向b極移動
C. b極上發生的電極反應為:2CrO42-+2H+=Cr2O72-+H2O
D. 理論上a、b兩電極放出的氣體的物質的量之比為2︰1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com