
【題目】元素化合價升高,表明該元素的原子(_____)電子,含該元素的物質發生(_____)反應,這種物質是(_____)劑。
 初中暑期銜接系列答案
初中暑期銜接系列答案科目:高中化學 來源: 題型:
【題目】鍍作為一種新興材料日益被重視,有“超級金屬…尖端金屬…空間金屬”之稱。工業上常用綠柱石(主要成分3BeO.Al2O3·6SiO2,還含有鐵等雜質)冶煉鈹,一種簡化的工藝流程如下:
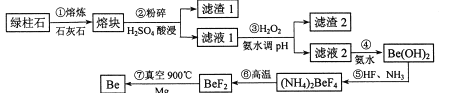
按元素周期表的對角線規則,Be和Al性質相似;幾種金屬陽離子的氫氧化物沉淀時的pH如表。回答下列問題:

(1)步驟②中將熔塊粉碎的目的是_____________;濾渣1的主要成分是________。
(2)步驟③加入H2O2時發生反應的離子方程式為__________,從濾液1中得到沉淀的合理pH為__________(填序號)。
A 3.3-3.7 8 3.7—5.0 C 5.0~5.2 D.5.2—6.5
(3)步驟④不宜使用NaOH溶液來沉淀Be2+的原因是_____________。從溶液中得到(NH4)2BeF4的實驗操作是_______、過濾、洗滌、干燥。
(4)步驟⑥的反應類型是_______,步驟⑦需要隔絕空氣的環境,其原因是_____________。
(5)若綠柱石中Be0的含量為a%,上述過程生產Be的產率為b%,則1t該綠柱石理論上能生產含鈹量2%的鍍銅合金_______t。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有如圖所示裝置: 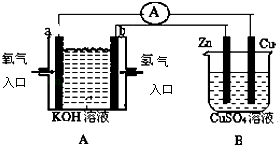
(1)裝置A中b為極,電極反應式為;
(2)B裝置中Cu為極,電極反應式為;
(3)當銅片的質量變化為12.8g時,a極上消耗的O2在標準狀況下的體積為 L.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,CuSO4(s)和 CuSO4·5H2O(s)溶于水及CuSO4·5H2O受熱分解的能量變化如圖所示,下列說法不正確的是
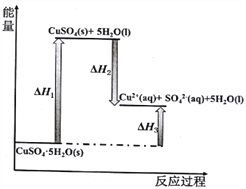
A. 將CuSO4·5H2O(s)溶于水會使溶液溫度降低
B. 將CuSO4(s)溶于水會使溶液溫度升高
C. △H3>△H2
D. △H1=△H2+△H3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在化學反應中,只有極少數能量比平均能量高得多的反應物分子發 生碰撞時才可能發生化學反應,這些分子被稱為活化分子。使普通分子變成活化分子所需提供的最低限度的能量叫活化能,其單位通常用 kJ/mol 表示。請認真觀察下圖,然后 回答問題。

(1)圖中所示反應是_____(填“吸熱”或“放熱”)反應。
(2)已知拆開 1mol H—H 鍵、1mol I—I、1mol H—I 鍵分別需要吸收的能量為 436kJ、151kJ、299kJ。則由 1mol 氫氣和 1mol 碘反應生成 HI 會_____(填“放出”或“吸 收”)______kJ 的熱量。在化學反應過程中,是將_____轉化為_________。
(3)下列反應中,屬于放熱反應的是_____,屬于吸熱反應的是_____。
①物質燃燒 ②炸藥爆炸 ③酸堿中和反應 ④二氧化碳通過熾熱的碳
⑤食物因氧化而腐敗 ⑥Ba(OH)2·8H2O 與 NH4Cl 反應 ⑦鐵粉與稀鹽酸反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2是引起“溫室效應”的主要物質,CO2的甲烷化可以實現其循環利用。
甲烷化過程中,可能發生如下反應:
I. CO2 (g)+4H2(g) ![]() CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
II. CO2 (g)+4H2(g) ![]() CO(g)+2H2O(g) △H2
CO(g)+2H2O(g) △H2
已知反應II中相關的化學鍵鍵能數據如下:
化學鍵 | H—H | C=O | C | H—O |
E/(kJ·mol-1) | 436 | 750 | 1076 | 463 |
由此計算△H2=_________________。
(2)在常壓、催化劑條件下,將CO2 和H2 (體積比為1:4,總物質的量為m mol)置于密閉容器中,發生反應I和II。測得CO2轉化率、CH4和CO選擇性隨溫度變化情況分別如圖1和圖2所示(選擇性:轉化的CO2中生成CH4或CO的百分比)

①由圖1和圖2可知,△H1___0(填“>”或“<”),____________可影響催化劑的選擇性。
②由圖1可知CO2的轉化率呈現先升高后降低的變化趨勢,其原因是________________________________。
③下列措施能提高CO2平衡轉化率的是__________(填標號)
A.提高原料氣中H2所占比例 B.適當增大壓強 C.升高溫度 D.增大催化劑的比表面積 E.前段加熱,后段冷卻
④350℃時,反應在t1時刻達到平衡,平衡時容器體積為VL,該溫度下反應I的平衡常數為_____(用m、V表示)。
⑤550℃時,反應在t2時刻達到平衡,此時容器中H2O(g)的物質的量為__mol(用m表示)
(3)CO2與NaOH溶液反應得到Na2CO3溶液。電解Na2CO3溶液的原理如圖所示,陽極的電極反應式為______________________________________。
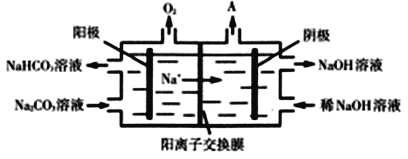
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E的原子序數依次增大,其中E不屬于短周期元素,常見單質分子B2中含有3對共用電子對,D的最外層電子數是周期序數的2倍,E單質是一種紫紅色金屬,甲、乙、丙是上述部分元素組成的二元化合物.且乙、丙分子所含電子總數相同,轉化關系如圖所示,其中甲是黑色固體,丙是一種常見的無色液體。下列說法不正確的是
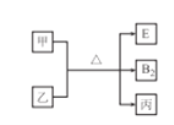
A. 乙分子中共用電子對數目與B2分子相同
B. 單質D與E在加熱時可生成1:1型化合物
C. 原子半徑:B>C
D. C與D位于同一主族,與B位于同一周期
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y均為短周期元素,X原子的最外層有2個電子,Y原子的最外層有7個電子,這兩種元素形成化合物的化學式是
A. XY B. XY2 C. X2Y D. X2Y3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com