
|
如下圖所示,反應:X(氣)+3Y(氣) | |
A. |
|
B. |
|
C. |
|
D. |
|
 輕松奪冠全能掌控卷系列答案
輕松奪冠全能掌控卷系列答案科目:高中化學 來源: 題型:
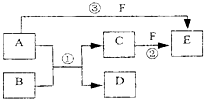 A、B、C、D、E、F六種物質的相互轉化關系如下圖所示(反應條件未標出),
A、B、C、D、E、F六種物質的相互轉化關系如下圖所示(反應條件未標出),
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解


滴定次數 |
鹽酸的體積/mL |
NaOH溶液的體積/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 2.00 | 20.20 |
| 2 | 25.00 | 1.02 | 21.03 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:
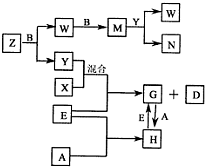 (2012?南充模擬)A、B、C、D、E是五種中學常見的單質,已知A、B、C、D在常溫下均為氣體.E是地殼中含量居第二位的金屬.D可分別跟A、B、C在一定的條件下化合,生成X、Y、Z;Y、Z與Ne的電子數相等,A是第三周期的元素.有關的轉化關系如下圖所示(反應條件均已略去):
(2012?南充模擬)A、B、C、D、E是五種中學常見的單質,已知A、B、C、D在常溫下均為氣體.E是地殼中含量居第二位的金屬.D可分別跟A、B、C在一定的條件下化合,生成X、Y、Z;Y、Z與Ne的電子數相等,A是第三周期的元素.有關的轉化關系如下圖所示(反應條件均已略去):

 5N2+6H2O
5N2+6H2O 5N2+6H2O
5N2+6H2O NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化學 來源: 題型:
 下圖所示(反應條件均已略去).
下圖所示(反應條件均已略去).
| ||
| △ |
| ||
| △ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com