
【題目】已知:![]() 、
、![]()
I.冠心平F是降血脂、降膽固醇的藥物,它的一條合成路線如下:
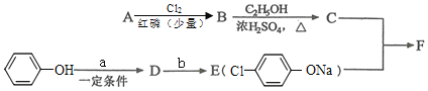
(1)A為一元羧酸,8.8gA與足量NaHCO3溶液反應生成2.24LCO2(標準狀況),A的分子式為____________。
(2)寫出符合A分子式的所有甲酸酯的結構簡式:________________。
(3)B是氯代羧酸,其核磁共振氫譜有兩個峰,寫出B→C的反應方程式:____________。
(4)C+E→F的反應類型為____________。
(5)寫出A和F的結構簡式:____________。
(6)D的苯環(huán)上有兩種氫,它所含官能團的名稱為_____________;寫出b所代表的試劑為____________。
II.有機物H的分子式為C2H2O3,可發(fā)生銀鏡反應,且具有酸性。
(7)H有多種合成方法,在方框中寫出由乙酸合成H的路線流程圖(其他原料任選)。合成路線流程圖示例如下:![]() ________________________________________________。
________________________________________________。
【答案】 C4H8O2 ![]()
![]()
 取代反應
取代反應 ![]()
 羥基、氯原子 NaOH溶液
羥基、氯原子 NaOH溶液 ![]()
【解析】分析:A為一元羧酸,n(CO2)=![]() =0.1mol,則n(A)=0.1mol,M(A)=
=0.1mol,則n(A)=0.1mol,M(A)=![]() =88g/mol,用殘基商余法,
=88g/mol,用殘基商余法,![]() =3……7,A的分子式為C4H8O2。A→B發(fā)生題給已知的取代反應,B是氯代羧酸,B的核磁共振氫譜有兩個峰,B的結構簡式為
=3……7,A的分子式為C4H8O2。A→B發(fā)生題給已知的取代反應,B是氯代羧酸,B的核磁共振氫譜有兩個峰,B的結構簡式為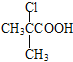 ,A的結構簡式為
,A的結構簡式為![]() ;B與CH3CH2OH發(fā)生酯化反應生成C,C的結構簡式為
;B與CH3CH2OH發(fā)生酯化反應生成C,C的結構簡式為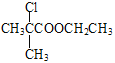 。根據
。根據![]() →D→E、E的結構簡式,D的苯環(huán)上有兩種氫,D的結構簡式為
→D→E、E的結構簡式,D的苯環(huán)上有兩種氫,D的結構簡式為![]() ;E與C發(fā)生題給已知的反應,F的結構簡式為
;E與C發(fā)生題給已知的反應,F的結構簡式為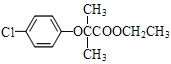 。
。
詳解:A為一元羧酸,n(CO2)=![]() =0.1mol,則n(A)=0.1mol,M(A)=
=0.1mol,則n(A)=0.1mol,M(A)=![]() =88g/mol,用殘基商余法,
=88g/mol,用殘基商余法,![]() =3……7,A的分子式為C4H8O2。A→B發(fā)生題給已知的取代反應,B是氯代羧酸,B的核磁共振氫譜有兩個峰,B的結構簡式為
=3……7,A的分子式為C4H8O2。A→B發(fā)生題給已知的取代反應,B是氯代羧酸,B的核磁共振氫譜有兩個峰,B的結構簡式為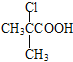 ,A的結構簡式為
,A的結構簡式為![]() ;B與CH3CH2OH發(fā)生酯化反應生成C,C的結構簡式為
;B與CH3CH2OH發(fā)生酯化反應生成C,C的結構簡式為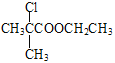 。根據
。根據![]() →D→E、E的結構簡式,D的苯環(huán)上有兩種氫,D的結構簡式為
→D→E、E的結構簡式,D的苯環(huán)上有兩種氫,D的結構簡式為![]() ;E與C發(fā)生題給已知的反應,F的結構簡式為
;E與C發(fā)生題給已知的反應,F的結構簡式為 。
。
(1)根據上述分析,A的分子式為C4H8O2。
(2)符合A分子式的所有甲酸酯的結構簡式為:HCOOCH2CH2CH3、![]() 。
。
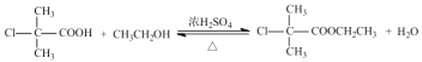
(3)B的結構簡式為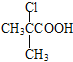 ,B與CH3CH2OH發(fā)生酯化反應生成C,B→C的化學方程式為:
,B與CH3CH2OH發(fā)生酯化反應生成C,B→C的化學方程式為: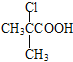 +CH3CH2OH
+CH3CH2OH![]()
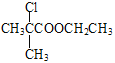 +H2O。
+H2O。
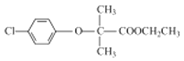
(4)對比C、E、F的結構簡式,C+E→F為取代反應。
(5)根據上述分析A的結構簡式為![]() ,F(xiàn)的結構簡式為
,F(xiàn)的結構簡式為 。
。
(6)D的苯環(huán)上有兩種氫,D的結構簡式為![]() ,D中所含官能團的名稱為:羥基和氯原子。對比D和E的結構簡式,b能與酚羥基反應生成酚鈉,b所代表的試劑為NaOH溶液或Na2CO3溶液。
,D中所含官能團的名稱為:羥基和氯原子。對比D和E的結構簡式,b能與酚羥基反應生成酚鈉,b所代表的試劑為NaOH溶液或Na2CO3溶液。
(7)H的分子式為C2H2O3,H可發(fā)生銀鏡反應且具有酸性,H的結構簡式為![]() 。對比CH3COOH和
。對比CH3COOH和![]() 的結構,碳干骨架沒有變化,羧基不變,在甲基上引入含氧官能團,結合題給已知以及有機物之間的轉化關系,CH3COOH與Cl2在紅磷(少量)存在時發(fā)生取代反應生成
的結構,碳干骨架沒有變化,羧基不變,在甲基上引入含氧官能團,結合題給已知以及有機物之間的轉化關系,CH3COOH與Cl2在紅磷(少量)存在時發(fā)生取代反應生成![]() ,
,![]() 在NaOH水溶液中發(fā)生水解反應生成
在NaOH水溶液中發(fā)生水解反應生成![]() ,
,![]() 酸化生成
酸化生成![]() ,
,![]() 發(fā)生催化氧化反應生成
發(fā)生催化氧化反應生成![]() 。合成路線為:CH3COOH
。合成路線為:CH3COOH![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 。
。


科目:高中化學 來源: 題型:
【題目】如下圖,a、b是石墨電極,通電一段時間后,b極附近溶液顯紅色。下列說法正確的是
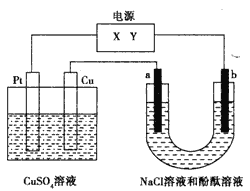
A. Pt為陰極,Cu為陽極
B. b極的電極反應式是2H++2e-=H2↑
C. 電解過程中CuSO4溶液的pH逐漸增大
D. Pt極上有6.4 g Cu析出時,b極產生2.24 L(標準狀況)氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現(xiàn)有陽離子交換膜,陰離子交換膜、石墨電極和如圖所示的電解槽。利用氯堿工業(yè)中的離子交換膜技術原理,可電解Na2SO4溶液生產NaOH溶液和H2SO4溶液。下列說法中正確的是
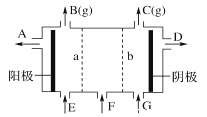
A. 陰極反應式為4OH--4e-=2H2O+O2↑ B. 從A口出來的是NaOH溶液
C. b是陽離子交換膜,允許Na+通過 D. Na2SO4溶液從G口加入
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作正確且能達到相應目的的是
選項 | 實驗目的 | 實驗操作 |
A | 稱取2.0gNaOH固體 | 先在托盤上各放1張濾紙,然后在右盤上添加2g砝碼,左盤上添加NaOH固體 |
B | 配制稀硫酸 | 先將濃硫酸加入燒杯,后倒入蒸餾水 |
C | 驗證鐵的吸氧腐蝕 | 將鐵釘放入試管中,用鹽酸浸沒 |
D | 檢驗溶液中是否有NH4+ | 取少量試液于試管中,加入NaOH溶液并加熱,用濕潤的紅色石蕊試紙檢驗產生的氣體 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C、N、O、Na、Mg、Al、S、Cl是常見的八種元素,根據元素及其化合物性質,回答下列問題:
(1)S在周期表中的位置為______;CO2的電子式是_______。
(2)比較O、Na元素常見離子的半徑大小(用化學式表示,下同)____>____;__________比較S、Cl元素的最高價氧化物對應水化物的酸性強弱:____>____ 。_______________
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
類型 | 離子化合物 | 離子化合物 | 離子化合物 | 共價化合物 |
熔點/℃ | 2800 | 2050 | 714 | 191 |
工業(yè)制鎂時,電解MgCl2而不電解MgO的原因是___________;制鋁時,電解Al2O3而不電解AlCl3的原因是___________ 。
(4)碳與鎂形成的1mol化合物Q與水反應,生成2molMg(OH)2和1mol烴,該烴分子中碳氫質量比為9:1,烴的結構簡式為______;Q的化學式為_______ 。
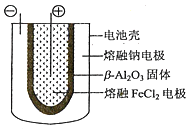
(5)熔融狀態(tài)下,鈉和FeCl2能組成可充電電池(裝置示意圖如下),反應原理為:2Na+FeCl2![]() Fe+2NaCl.放電時,電池的正極反應式為___________;充電時,_______(寫物質名稱)電極接電源的負極;該電池的電解質為_______。
Fe+2NaCl.放電時,電池的正極反應式為___________;充電時,_______(寫物質名稱)電極接電源的負極;該電池的電解質為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國多條高壓直流電線路的瓷絕緣子出現(xiàn)鐵帽腐蝕現(xiàn)象,在鐵帽上加鋅環(huán)能有效防止鐵帽的腐蝕,防護原理如圖所示。下列說法錯誤的是
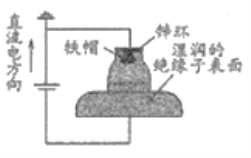
A. 通電時,鋅環(huán)是陽極,發(fā)生氧化反應
B. 通電時,陰極上的電極反應為2H2O+2e-=H2↑+2OH-
C. 斷電時,鋅環(huán)上的電極反應為Zn2++2e-=Zn
D. 斷電時,仍能防止鐵帽被腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)利用VSEPR推斷分子或離子的空間構型。
PO![]() __________;CS2____________;AlBr3(共價分子)__________。
__________;CS2____________;AlBr3(共價分子)__________。
(2)有兩種活性反應中間體粒子,它們的粒子中均含有1個碳原子和3個氫原子。請依據下面給出的這兩種粒子的球棍模型,寫出相應的化學式:
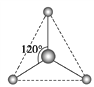 ______;
______;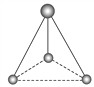 ______。
______。
(3)按要求寫出第二周期非金屬元素構成的中性分子的化學式。
平面三角形分子________,三角錐形分子________,四面體形分子________。
(4)為了解釋和預測分子的空間構型,科學家在歸納了許多已知的分子空間構型的基礎上,提出了一種十分簡單的理論模型——價層電子對互斥模型。這種模型把分子分成兩類:一類是____________________;另一類是____________________。BF3和NF3都是四個原子的分子,BF3的中心原子是________,NF3的中心原子是________;BF3分子的立體構型是平面三角形而NF3分子的立體構型是三角錐形的原因是____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】MgO、Al2O3都是常用的耐火材料,某研究小組取100 kg含60%Al的報廢汽車的鎂合金材料來制備MgO、Al2O3,其中物質甲可由溶液B轉化再生,其工藝流程如圖所示。
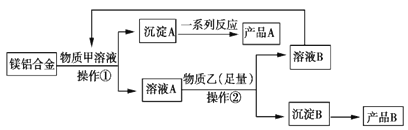
請回答下列問題:
(1)下列說法正確的是__________(填字母)。
A.合金是金屬與金屬熔合而成的混合物
B.合金的熔點比成分金屬更高
C.合金的硬度等機械性能優(yōu)于成分金屬
D.氧化鋁熔點高,故可以用氧化鋁坩堝熔融氫氧化鈉
(2)物質甲是________________,產品A是________________。
(3)操作②為____________。
(4)足量物質乙與溶液A發(fā)生反應的離子方程式為___________________________。
(5)假設不計損耗,可得產品B的質量為__________kg。(保留一位小數(shù))
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用勒夏特列原理解釋的是
A. 加壓有利于SO2與O2反應生成SO3 B. 500度左右比常溫下更有利于合成氨
C. 將氨氣液化,有利于合成氨的反應 D. 用過量空氣煅燒硫鐵礦可以提高原料利用率
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com