
【題目】現有m g某氣體,它由雙原子分子構成,它的摩爾質量為M g/mol。若阿伏加德羅常數用NA表示,則:
(1)該氣體所含原子總數為_________________個。
(2)該氣體溶于1L水中(不考慮反應),其溶液中溶質的質量分數為____________。(水的密度為1g/mL)
(3)該氣體溶于水后形成V L溶液,其溶液的物質的量濃度為_________mol/L。
科目:高中化學 來源: 題型:
【題目】氮的固定是幾百年來科學家一直研究的課題。請回答下列問題:
(1)下表列舉了不同溫度下大氣固氮和工業固氮的部分K值。
反應 | 大氣固氮 N2 (g)+O2 (g) | 工業固氮 N2 (g)+3H2 (g) | |||
溫度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析數據可知:大氣固氮反應屬于 ________(填“吸熱”或“放熱”)反應。
②分析數據可知:人類不適合大規模模擬大氣固氮的原因是 ________。
③從平衡視角考慮,工業固氮應該選擇常溫條件,但實際工業生產卻選擇500℃左右的高溫,解釋其原因 ________。
(2)已知工業固氮反應:N2(g)+ 3H2(g)![]() 2NH3(g)ΔH =-94.4kJ·mol-1,恒容時,體系中各物質濃度隨時間變化的曲線如圖1所示,各時間段最終均達平衡狀態。
2NH3(g)ΔH =-94.4kJ·mol-1,恒容時,體系中各物質濃度隨時間變化的曲線如圖1所示,各時間段最終均達平衡狀態。
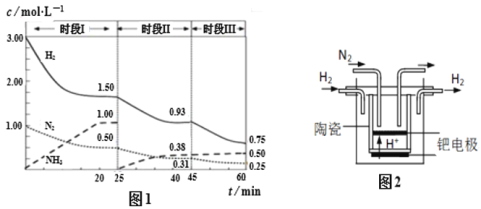
①在2L容器中發生反應,前20min內,ν(NH3) = ________。
②25 min時采取的某種措施是 ________。
③時段III條件下反應的平衡常數為 ________ L2· mol-2(保留3位有效數字) 。
(3)20世紀末,科學家采用高質子導電性的SCY陶瓷(能傳遞H+)為介質,用吸附在它內外表面上的金屬鈀多晶薄膜做電極,實現高溫常壓下的電解法合成氨,提高了反應物的轉化率,其實驗簡圖如圖2所示,陰極的電極反應式是 ________。
(4)近年,又有科學家提出在常溫、常壓、催化劑等條件下合成氨氣的新思路,反應原理為:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g),則其反應熱ΔH = ________。已知:N2(g)+ 3H2(g)
4NH3(g)+3O2(g),則其反應熱ΔH = ________。已知:N2(g)+ 3H2(g)![]() 2NH3(g) ΔH1 =-92.4kJ·mol-1 2H2(g) +O2(g)
2NH3(g) ΔH1 =-92.4kJ·mol-1 2H2(g) +O2(g)![]() 2H2O(l) ΔH2 =-571.6kJ·mol-1
2H2O(l) ΔH2 =-571.6kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學設計了測定氣體摩爾體積的探究實驗,利用氯酸鉀分解制O2。

實驗步驟如下:
①連接好實驗裝置,檢查裝置的氣密性。
②把適量的氯酸鉀粉末和少量二氧化錳粉末混合均勻,放入干燥的試管中,準確稱量試管和藥品的總質量為15.95 g。
③加熱,開始反應,直到不再有氣體產生為止。
④測量排入量筒中水的體積為285.0 mL,換算成標準狀況下氧氣的體積為279. 7 mL。
⑤準確稱量試管和殘留物的質量為15. 55 g。
根據上述實驗過程,回答下列問題:
(1)如何檢查裝置的氣密性?____________________________________________。
(2)以下是測量收集的氣體體積必須包括的幾個步驟:
①調整量筒的高度使廣口瓶和量筒內的液面高度相同;
②使試管和廣口瓶內氣體都冷卻至室溫;
③讀取量筒內液體的體積。
這三步操作的正確順序是_________________(請填寫步驟代號)。
進行③的實驗操作時,若仰視讀數,則讀取氧氣的體積_______(填“偏大”“偏小”或“無影響”)。
(3)實驗過程中產生氧氣的物質的量是_____mol;實驗測得氧氣的氣體摩爾體積是______(保留小數點后兩位)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是( )
A. 糖類、油脂和蛋白質都是天然高分子化合物
B. 煤的干餾和石油的分餾都是化學變化
C. 催化裂化的目的是提高汽油、煤油和柴油等輕質油的產量
D. 由煤的干餾可知煤中含苯、二甲苯等芳香族化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素T、Q、R、W在元素周期表中的位置如右圖所示,其中T所處的周期序數與主族族序數相等。它們的最高價氧化物的水化物依次為甲、乙、丙、丁。下列敘述不正確的是
A. R的氫化物可以既有極性鍵又有非極性鍵
B. 常溫下丁的濃溶液可用T單質所制的容器來盛裝
C. 丁的濃溶液與Q的單質加熱發生反應,可生成體積比為1:2的兩種氣體
D. 甲、乙、丙、丁受熱均易分解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2SO2(g)+O2(g)![]() 2SO3(g)是工業制硫酸的主要反應之一。一定溫度下,在甲、乙、丙、丁四個容器體積均為2 L的恒容密閉容器中投料,其起始物質的量及含硫反應物的平衡轉化率如下表所示:
2SO3(g)是工業制硫酸的主要反應之一。一定溫度下,在甲、乙、丙、丁四個容器體積均為2 L的恒容密閉容器中投料,其起始物質的量及含硫反應物的平衡轉化率如下表所示:
甲 | 乙 | 丙 | 丁 | ||
起始物質的量 | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
含硫反應物的平衡轉化率% | 80 |
|
|
| |
下列判斷中,正確的是
A. 該溫度下,平衡常數的值為400 B. 平衡時,丙中c(SO3)是甲中的2倍
C. 平衡時,ɑ3>ɑ1 D. 乙中SO3的平衡轉化率為ɑ1 = 20%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.配制480 mL 0.3 mol/L NaOH溶液。具體如下:
(1)需_________g NaOH。
(2)配制過程中,下列儀器不會用到的是_____(填字母),尚缺少的玻璃儀器有_____、______。
A.托盤天平 B.250 mL容量瓶 C.玻璃棒 D.膠頭滴管
(3)實驗過程中兩次用到玻璃棒,其作用分別是: _____________、_______________。
(4)下列操作的正確順序是:B→_____→_____→____→____→____→G (用字母表示)。
A.冷卻 B.稱量C.洗滌 D.定容E.溶解 F.轉移 G.搖勻
Ⅱ.乙同學用18.4 mol/L濃硫酸配制100 mL 3.6 mol/L的稀硫酸。用100 mL量筒量取20.0 mL濃硫酸,并向其中小心地加入少量水,攪拌均勻,待冷卻至室溫后,再加入水至100 mL刻度線,再攪拌均勻。你認為此法是否正確?________若不正確,指出其中錯誤之處______。
Ⅲ.在配制物質的量濃度溶液時,判斷下列操作出現的后果。(填“偏低”、“偏高”或“無影響”)
(1)配制氫氧化鈉溶液時,稱取已吸潮的氫氧化鈉固體:________。
(2)配制氫氧化鈉溶液時,容量瓶中有少量水:_______。
(3)發現溶液液面超過刻度線,用吸管吸出少量水,使液面降至刻度:______。
(4)轉移時不慎將溶液倒在瓶外:__________;
(5)定容時俯視容量瓶刻度線:____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知2A2(g)+B2(g)![]() 2C(g) ΔH=-a kJ·mol-1(a > 0),在一個有催化劑的固定容積的容器中加入2 mol A2和1 mol B2,在500 ℃時充分反應達到平衡后C的濃度為w mol·L-1,放出熱量b kJ。
2C(g) ΔH=-a kJ·mol-1(a > 0),在一個有催化劑的固定容積的容器中加入2 mol A2和1 mol B2,在500 ℃時充分反應達到平衡后C的濃度為w mol·L-1,放出熱量b kJ。
(1)a___(填“>”“=”或“<”)b。
(2)若將反應溫度升高到700 ℃,該反應的平衡常數將__(填“增大”“減小”或“不變”)。
(3)若在原來的容器中,只加入2 mol C,500 ℃時充分反應達到平衡后,吸收熱量c kJ,C的濃度___(填“>”“=”或“<”)w mol·L-1。
(4)能說明該反應已經達到平衡狀態的是___。(填序號,下同)
a.v(C)=2v(B2) b.容器內壓強保持不變
c.v逆(A2)=2v正(B2) d.容器內氣體的密度保持不變
(5)使該反應的反應速率增大,且平衡向正反應方向移動的操作是___;能使B的轉化率增大的操作是________;使平衡向逆反應方向移動的操作是________。
a.及時分離出C氣體 b.適當升高溫度
c.增大B2的濃度 d..選擇高效的催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,水的電離達到平衡:H2O![]() H++OH-,下列敘述正確的是( )
H++OH-,下列敘述正確的是( )
A. 將純水加熱到95 ℃時,KW變大,pH不變,水仍呈中性
B. 向純水中加入少量NaOH溶液,平衡逆向移動, KW變小
C. 向純水中加入少量鹽酸,平衡逆向移動,c(H+)增大,KW不變
D. 向純水中加入醋酸鈉,平衡正向移動,KW增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com