
【題目】Ⅰ.國產C919大型客機的正式下線,標志著我國航空工業進入了新的發展階段,我國成為世界上少數幾個具有自行研制大型飛機的國家之一。
(1)飛機的外殼通常采用鎂一鋁合金材料,鋁的價電子排布圖為_______________,第一電離能:鋁________(填“大于”或“小于”)鎂。
(2)為了減輕質量而不減輕外殼承壓能力,現代飛機通常采用復合材料一玻璃纖維增強塑料,其成分之一為環氧樹脂,常見的E51型環氧樹脂中部分結構如圖甲所示,其中碳原子的雜化方式為___________,該材料此部分中所含元素的電負性從小到大的順序為_______________。

II.大型飛機的發動機在制造過程中通常采用碳化鎢做關鍵部位的材料。
(1)鎢元素位于周期表的第六周期第VIB族,請寫出其位于同一族的元素鉻的原子的價電子排布式__________________,
(2)圖乙為碳化鎢晶體的一部分結構,碳原子嵌入金屬鎢的晶格的間隙,并不破壞原有金屬的晶格,形成填隙+固溶體,也稱為填隙化合物。在此結構中,其中鎢原子有_______個,1個鎢原子周圍距離鎢原子最近的碳原子有_______個,下列金屬元素的堆積方式與碳化鎢晶胞中碳原子和鎢原子所處位置類似的是___________(填序號)。
A.Fe Cu B.Ti Au C.Mg Zn D.Cu Ag
(4)設該部分晶體的體積為Vcm3,碳化鎢的摩爾質量為M g/mol,密度為b g/cm3,則阿伏加德羅常數NA用上述數據可以表示為____________________。
【答案】 ![]() 小于 sp2、sp3雜化 H<C<O 3d54s1 6 6 B
小于 sp2、sp3雜化 H<C<O 3d54s1 6 6 B ![]()
【解析】本題主要考查物質結構。
Ⅰ.(1)飛機的外殼通常采用鎂一鋁合金材料,鋁的價電子排布圖為![]() ,鎂的3p電子半充滿,能量低,較穩定,所以第一電離能:鋁小于鎂。
,鎂的3p電子半充滿,能量低,較穩定,所以第一電離能:鋁小于鎂。
(2)常見的E51型環氧樹脂中部分結構如圖24 甲所示,其中單鍵碳原子的雜化方式為sp3雜化,雙鍵碳原子的雜化方式為sp2雜化,該材料此部分中所含元素的電負性從小到大的順序為H<C<O。
II.(1)元素鉻的原子的價電子排布式:3d54s1。
(2)在此結構中,其中鎢原子有6個,1個鎢原子周圍距離鎢原子最近的碳原子有6個,下列金屬元素的堆積方式與碳化鎢晶胞中碳原子和鎢原子所處位置類似的是B。
(4)該部分晶體含有6個碳原子,6個鎢原子,b=6M/(VNA),NA=![]() 。
。


科目:高中化學 來源: 題型:
【題目】草酸的組成用H2C2O4表示,為了測定某草酸溶液的濃度,進行如下實驗:稱取Wg草酸晶體,配成100.00mL水溶液,取25.00mL所配制的草酸溶液置于錐形瓶內,加入適量稀H2SO4后,用濃度為amolL﹣1的KMnO4溶液滴定到KMnO4不再褪色為止,所發生的反應為:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.
試回答:
(1)實驗中,標準液KMnO4溶液應裝在式滴定管中,因為 .
(2)實驗中眼睛注視 , 直至滴定終點.判斷到達終點的現象是 .
(3)實驗中,下列操作(其它操作均正確),會對所測草酸濃度有什么影響?(填偏大、偏小、無影響)
A. 滴定前仰視刻度,滴定后俯視刻度 .
B. 錐形瓶在盛放待測液前未干燥,有少量蒸餾水 .
C. 滴定過程中搖動錐形瓶,不慎將瓶內的溶液濺出一部分 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如表是元素周期表的一部分,參照元素在表中的位置,請用化學用語回答下列問題:
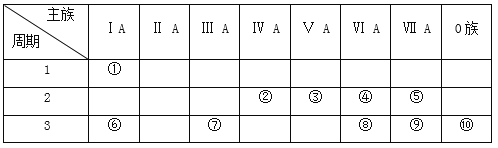
(1)在上述元素最高價氧化物對應水化物中,酸性最強的是_______________,堿性最強的是_____________,顯兩性的是_____________。(化學式)
(2)這些元素中,化學性質最不活潑原子的原子結構示意圖為__________;氣態氫化物中,最穩定的是_________(化學式),②③④⑤形成的氫化物中沸點最高的是_______(化學式)。
(3)①和④兩種元素的原子按1:1組成的常見化合物的電子式為_____________。
(4)④、⑥、⑦、⑨的簡單離子半徑由大到小的順序為______________________________(用離子符號和“>”表示)。
(5)⑥和⑦的最高價氧化物對應水化物之間發生反應的化學方程式_____________________。
(6)為了證明⑥和⑦兩種元素的金屬性強弱,下列說法或實驗能提供證據的是_______。
A.比較兩種元素的單質的熔點、沸點高低
B.將兩種元素的單質分別與冷水反應,觀察反應的劇烈程度
C.比較兩種元素的最高價氧化物對應的水化物的堿性強弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應C(s)+H2O(g) ![]() CO(g)+H2(g) ;ΔH >0,下列有關說法正確的是
CO(g)+H2(g) ;ΔH >0,下列有關說法正確的是
A.平衡常數表達式為 ![]()
B.增大體系壓強,平衡常數K不發生變化
C.升高體系溫度,平衡常數K減小
D.增加C(s)的量,平衡正向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(題文)已知某反應中能量變化如圖所示,所得結論錯誤的是( )
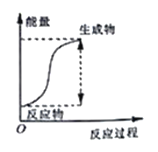
A. 該圖像可以表示氯化銨與消石灰反應的能量變化
B. 該反應過程中,一定有其他形式的能量轉化成化學能
C. 該反應過程中,形成新化學鍵釋放的總能量小于斷裂舊化學鍵吸收的總能量
D. 因為生成物的總能量高于反應物的總能量,所以該反應一定需要加熱才可進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將一定量的氨基甲酸銨置于密閉真空容器中(固體體積忽略不計)發生反應:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)△H,達到平衡時測得c(CO2)=amol·L-1。溫度不變,達到平衡后壓縮容器體積至原來的一半,達到新平衡時測得c(NH3)=xmol·L-1。下列說法正確的是( )
2NH3(g)+CO2(g)△H,達到平衡時測得c(CO2)=amol·L-1。溫度不變,達到平衡后壓縮容器體積至原來的一半,達到新平衡時測得c(NH3)=xmol·L-1。下列說法正確的是( )
A. 混合氣體的平均相對分子質量不再變化時表明達到平衡狀態
B. 達到新平衡時,△H為原來的2倍
C. 上述反應達到新平衡狀態時x=2a
D. 上述反應體系中,壓縮容器體積過程中n(H2NCOONH4)不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人們常常利用化學反應中的能量變化為人類服務。
(1)氫能是一種具有發展前景的理想清潔能源,氫氣燃燒時放出大最的熱。氫氣燃燒生成水蒸氣的能最變化如下圖所示:

根據上圖可知,在化學反應中,不僅存在物質的變化,而且伴隨著______變化,1molH2完全燃燒生成1molH2O(氣態)時,釋放的能量是_______kJ。
(2)下列化學反應在理論上可以設計成原電池的是________。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.CH4+2O2![]() CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
(3)下圖是某興趣小組設計的原電池示意圖,實驗結束后,在實驗報告上記錄信息如下:

a.電流計指針偏轉 |
b.Cu極有H2產生 |
c.H+向負極移動 |
d.電流由Zn經導線流向Cu |
①實驗報告中記錄合理的是_______(填序號)。
②請寫出該電池的負極反應式_________。
③若有1mol電子流過導線,則理論上產生H2的質量為______g.
④將稀H2SO4換成CuSO4溶液,電極質量增加的是______(填“鋅極”或“銅極”,下同),溶液中SO42-移向_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:C(s)+ ![]() O2(g)=CO(g) ΔH=-110.35kJ·mol-1
O2(g)=CO(g) ΔH=-110.35kJ·mol-1
CO(g)+ ![]() O2(g)=CO2(g) ΔH=-282.57kJ·mol-1
O2(g)=CO2(g) ΔH=-282.57kJ·mol-1
在6 g 碳不完全燃燒所得產物中,CO與CO2的體積比為2∶3, 與6 g碳完全燃燒相比,損失的熱量為( )
A.282.57 kJ
B.110.35 kJ
C.196.46 kJ
D.56.51 kJ
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com