
【題目】在反應3Cu +8HNO3(稀) == 3Cu(NO3)2 + 2NO↑ +4H2O 中
(1)用單線橋標出電子轉移___________________________
(2)還原劑是__________,被還原的元素是__________,還原產物是__________。
(3)若生成2mol的NO氣體,溶液中生成的Cu2+為___________mol。
(4)在反應中硝酸顯示_________性和____________性
 新活力總動員暑系列答案
新活力總動員暑系列答案 龍人圖書快樂假期暑假作業鄭州大學出版社系列答案
龍人圖書快樂假期暑假作業鄭州大學出版社系列答案科目:高中化學 來源: 題型:
【題目】在一個恒溫恒容的密閉容器中充入1 mol HI,建立如下平衡:2HI(氣)![]() H2(氣)+I2(氣),測得HI的轉化率為a%。保持恒溫恒容,在上述平衡體系中再充入2molHI,待新平衡建立后HI的轉化率為b%,則a與b的關系是
H2(氣)+I2(氣),測得HI的轉化率為a%。保持恒溫恒容,在上述平衡體系中再充入2molHI,待新平衡建立后HI的轉化率為b%,則a與b的關系是
A.a>b B.a<b C.a=b D.無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中正確的是 ( )
A.氯化鋁溶液中加入過量氨水反應的實質:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
B.在加入鋁粉能放出氫氣的溶液中,K+、NH![]() 、CO
、CO![]() 、Cl-一定能夠大量共存
、Cl-一定能夠大量共存
C.鎂鋁合金既可完全溶于過量鹽酸又可完全溶于過量NaOH溶液
D.依據鋁熱反應原理,能發生反應2Al+3MgO ![]() 3Mg+Al2O3
3Mg+Al2O3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鍶(Sr)為第五周期ⅡA族元素,其化合物六水氯化鍶(SrCl2·6H2O)是實驗室重要的分析試劑,工業上常以天青石(主要成分為SrSO4)為原料制備,生產流程如下:
已知:①經鹽酸浸取后,溶液中除含有Sr2+和Cl-外,還含有少量Ba2+雜質;
②SrSO4、BaSO4的溶度積常數分別為3.3×10-7、1.1×10-10;
③SrCl2·6H2O的摩爾質量為267 g/mol。
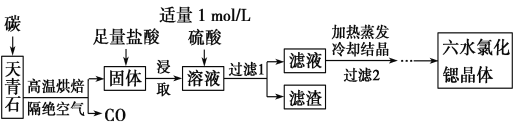
(1) 工業上天青石焙燒前先研磨粉碎,其目的是______________。
(2) 工業上天青石隔絕空氣高溫焙燒,若0.5 mol SrSO4中只有S被還原,轉移了4 mol電子。寫出該反應的化學方程式:_________________________。
(3)加入硫酸的目的是____________________________。為了提高原料的利用率,濾液中Sr2+的濃度應不高于___________mol/L(注:此時濾液中Ba2+濃度為1×10-5 mol/L)。
(4)產品純度檢測:稱取1.000 g產品溶解于適量水中,向其中加入含AgNO3 1.100×10-2mol的AgNO3溶液(溶液中除Cl-外,不含其他與Ag+反應的離子),待Cl-完全沉淀后,用含Fe3+的溶液作指示劑,用0.200 0 mol/L的NH4SCN標準溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反應達到終點的現象是_______________________。
②若滴定過程用去上述濃度的NH4SCN溶液20.00 mL,則產品中SrCl2·6H2O的質量百分含量為______________(保留4位有效數字)。
(5)工業上常用電解熔融SrCl2制鍶單質。由SrCl2·6H2O制取無水氯化鍶的方法是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】物質的量相等的A、B兩種氣體,下列說法中錯誤的是( )
A. 分子數目一定相等
B. 體積一定相等
C. 質量不一定相等
D. 分子中的原子數目可能相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】完成下反應的化學方祝式或離子方程式:
(1)鋁與黑色鐵的化合物(有磁性)反應_____________。
(2)工業上制粗硅的反應____________。
(3)硫酸鋁溶液中加入過量氨水的離子方程式____________。
(4)用稀鹽酸清洗銅器皿表面上的銅銹的離子方程式:____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨工業是工農業生產和國防工業的基礎產業,也是國民經濟的命脈產業。其原理如下:N2(g)+3H2(g)2NH3(g)△H〈 0 。
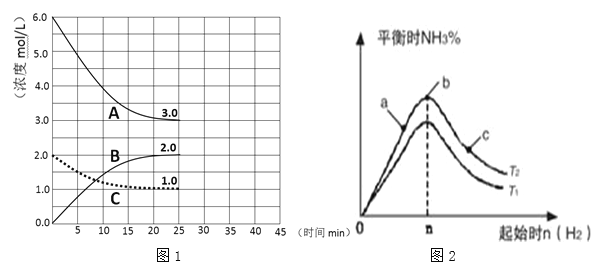
(1)在恒溫恒容裝置中進行合成氨反應,各組分濃度-時間圖像如圖1所示。
① 表示H2濃度變化的曲線是 (填序號)。
② 前25min 內,用NH3濃度變化表示的化學反應速率是 。
(2)某學習小組研究:在其他條件不變的情況下,研究改變起始物氫氣的物質的量對該合成氨反應的影響.實驗結果如圖2所示:(圖中T表示溫度,n表示物質的量)
①比較T1 T2 (填“>”,“<”, “=”)。
②比較在a、b、c三點N2的轉化率最高的是 ;H2的百分含量最高的是 (填字母)。
③在起始體系中加入N2的物質的量為 mol時(用含n的代數式表示),反應后氨的百分含量最大;若容器容積為1L,n=3mol反應達到平衡時H2的轉化率為60%,則在T2條件下,該反應的平衡常數K= 。(保留3位有效數字)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中的一定量混合氣體發生反應:x A(g) + y B(g) ![]() z C(g),平衡時測得A的濃度為0.5 mol/L,保持溫度不變,將容器的容積擴大到原來的兩倍,再次達到平衡時,測得A的濃度降低為0.3 mol/L,下列有關判斷正確的是( )
z C(g),平衡時測得A的濃度為0.5 mol/L,保持溫度不變,將容器的容積擴大到原來的兩倍,再次達到平衡時,測得A的濃度降低為0.3 mol/L,下列有關判斷正確的是( )
A.x + y < z B.B的轉化率降低
C.平衡向正反應方向移動 D.C的體積分數增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com