
【題目】據報道科研人員應用計算機模擬出結構類似C60的物質N60 。已知:①. N60分子中每個氮原子均以N—N鍵結合三個N原子而形成8電子穩定結構;②.N—N鍵的鍵能為167 kJ/mol,N≡N鍵的鍵能為942kJ/mol。試回答下列問題:
(1)N60組成的晶體為_______ 晶體,其熔、沸點比N2的 _______(高或低),其原因是__________ 。
(2)1mol N60 分解成N2時吸收或釋放的熱量為________________kJ。
(3)常溫常壓下,向50 mL 0.4mol/L的NaOH溶液中加入過量的稀H2SO4,測得放熱 a kJ.寫出上述反應的熱化學方程式:____________ 。
【答案】 分子 高 N60、N2均形成分子晶體,且N60的相對分子質量大,分子間作用力大,故熔、沸點高 13230 NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l) △H=-50a kJ/mol
【解析】(1)N60晶體的構成微粒為分子,所以屬于分子晶體;分子晶體中結構和組成相似,其相對分子質量越大熔、沸點越高,N60和N2都是分子晶體,N60相對分子質量大于N2,所以N60的熔、沸點比N2高,故答案為:分子;高;N60和N2都是分子晶體,N60相對分子質量大于N2,分子間作用力大,所以N60的熔、沸點比N2高;
(2)每個N原子均以氮氮單鍵結合三個氮原子,每個氮氮鍵被2個氮原子共用,每個氮原子有1.5個氮氮鍵,1個N60分子的結構中含有90個N-N鍵,則1molN60的總鍵能為167kJmol-1×90mol=15030kJ,生成30molN≡N鍵的鍵能為942kJmol-1×30mol=28260kJ,則反應放出能量為28260kJ-15030kJ=13230 kJ,1mol N60分解成N2時放出熱量13230kJ, 故答案為:13230;
(3)50 mL 0.4mol/L的NaOH中含有氫氧化鈉0.050 L ×0.4mol/L=0.002mol,反應生成0.02mol水,則生成1mol水放出的熱量為![]() ×a kJ=50a kJ,該反應的熱化學方程式為NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O (l) △H=-50a kJ/mol,故答案為:NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O (l) △H=-50a kJ/mol。
×a kJ=50a kJ,該反應的熱化學方程式為NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O (l) △H=-50a kJ/mol,故答案為:NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O (l) △H=-50a kJ/mol。


科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.淀粉、纖維素及其水解產物均屬于糖類
B.天然植物油常溫下一般呈液態,難溶于水,有恒定的熔點、沸點
C.蛋白質溶液中加硫酸銨或氯化銅溶液,均會發生蛋白質的變性
D.糖類、油脂、蛋白質均能發生水解反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】檸檬烯是一種食用香料,其結構簡式為: ![]() 有關檸檬烯的分析正確的是( )
有關檸檬烯的分析正確的是( )
A.分子式為C10H14
B.一定條件下,檸檬烯可以發生加成、取代、氧化、還原反應
C.檸檬烯有屬于苯的同系物的同分異構體
D.檸檬烯的分子中所有碳原子可能處在同一個平面上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用蓋斯定律可計算一些不易測定的反應的反應熱.
(1)已知在298K時下述反應的有關數據:C(s)+ ![]() O2(g)=CO(g)△H1=﹣110.5kJmol﹣1 , C(s)+O2(g)=CO2(g)△H2=﹣393.5kJmol﹣1 . 則C(s)+CO2(g)=2CO(g) 的△H為 .
O2(g)=CO(g)△H1=﹣110.5kJmol﹣1 , C(s)+O2(g)=CO2(g)△H2=﹣393.5kJmol﹣1 . 則C(s)+CO2(g)=2CO(g) 的△H為 .
(2)火箭發射時可用肼(N2H4)為燃料,以二氧化氮作氧化劑,它們相互反應生成氮氣和水蒸氣.已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJmol﹣l;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣l . 則N2H4和NO2反應生成氮氣和水蒸氣的熱化學方程式為
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出下列除雜的離子方程式,括號內的物質為雜質.
物質(雜質) | 離子方程式 |
FeCl2 (FeCl3) | (1) |
CO2 (HCl) | (2) |
NaHC03 溶液(Na2C03) | (3) |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】正丁醚常用作有機反應的溶劑.實驗室制備正丁醚的反應和主要實驗裝置如下:
2CH3CH2CH2CH2OH ![]() (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
反應物和產物的相關數據如下
相對分子質量 | 沸點/℃ | 密度/(gcm﹣3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 幾乎不溶 |
合成反應:
①將6mL濃硫酸和37g正丁醇,按一定順序添加到A中,并加幾粒沸石.
②加熱A中反應液,迅速升溫至135℃,維持反應一段時間.分離提純.
③待A中液體冷卻后將其緩慢倒人盛有70mL水的分液諞斗中,振搖后靜置,分液得粗產物.
④粗產物依次用40mL水、20mL NaOH溶液和40mL水洗滌,分液后加入約3g無水氯化鈣顆粒,靜置一段時間后棄去氯化鈣.
⑤將上述處理過的粗產物進行蒸餾,收集餾分,得純凈正丁醚11g.
請回答:
(1)步驟①中濃硫酸和正丁醇的添加順序為 .
(2)加熱A前,需先從 (填“a”或“b”)口向B中通入水.
(3)步驟③的目的是初步洗去 , 振搖后靜置,粗產物應從分液漏斗的(填“上”或“下”)口分離出.
(4)步驟③巾最后一次水洗的目的為 .
(5)步驟⑤中,加熱蒸餾時應收集(填選項字母)左右的餾分.a.100℃b.117℃c. 135℃d.142℃
(6)反應過程中會觀察到分水器中收集到液體物質,且分為上下兩層,隨著反應的進行,分水器中液體逐漸增多至充滿時,上層液體會從左側支管自動流回A.分水器中上層液體的主要成分為 , 下層液體的主要成分為 .
(7)本實驗中,正丁醚的產率為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,在1L的密閉容器中充入NO2發生如下反應:2NO2(g)N2O4(g);△H=﹣57kJmol﹣1
(1)該反應的△S0(填“>”、“<”或“=”).
(2)當開始充入0.03mol的NO2時,25℃時,實驗測得NO2的平衡濃度為0.01molL﹣1 , 則NO2的平衡轉化率(α)是 . 25℃時上述反應的平衡常數K= .
(3)25℃時,實驗測得該反應的活化能Ea=92.4kJmol﹣1 . 下列能量關系圖合理的是 . 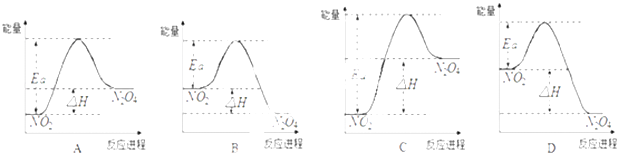
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液,一定呈中性的是
A. 由等體積、等物質的量濃度的硫酸跟NaOH溶液混合后所形成的溶液
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. c(H+)=![]() 的溶液(Kw為該溫度下水的離子積常數)
的溶液(Kw為該溫度下水的離子積常數)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com