
【題目】
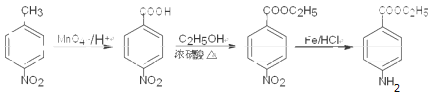
已知化合物Z(4 -乙酰氨基苯甲酸乙酯)是重要的化工中間體,其一種合成路徑如下:
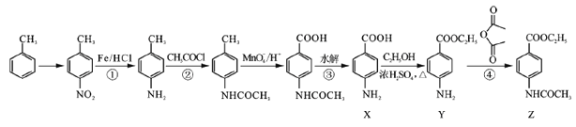
(1)反應①的反應類型為____________,Y中的含氧官能團名稱為____________。
(2)合成路徑中反應②、③的目的是_________________。
(3)試劑X可以脫水縮合為一種鏈狀高分子化合物,其結構簡式為__________________。
(4)寫出反應④的化學方程式_____________________。
(5)Y是一種醫用麻醉劑,其符合下列條件的同分異構體數目為________________種。
①苯環上有兩個取代基,其中一個為氨基(—NH2)且與苯環直接相連;
②能發生水解反應。
寫出其中能發生銀鏡反應且核磁共振氫譜中峰最少的同分異構體的結構簡式_________________。
(6)某同學進一步優化了上述合成路線,發現經三步反應即可將![]() 轉化成
轉化成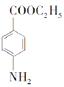 ,請寫出該同學的合成路線(無機試劑任選)。________
,請寫出該同學的合成路線(無機試劑任選)。________
【答案】 還原反應 酯基 保護氨基,不被酸性高錳酸鉀溶液氧化 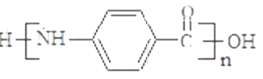
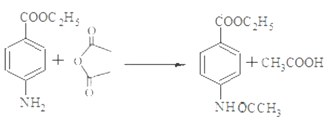 17
17 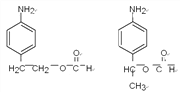
【解析】(1)反應①是甲苯的硝化反應,反應類型為取代反應;根據Y的結構簡式可知Y中的含氧官能團名稱為酯基。(2)由于氨基易被氧化,為了防止氧化甲基時氨基被氧化,合成路徑中反應②、③的目的是保護氨基,不被酸性高錳酸鉀溶液氧化。(3)試劑X中含有氨基和羧基,可以脫水縮合為一種鏈狀高分子化合物,其結構簡式為![]() 。(4)反應④是氨基上的氫原子被取代,反應的化學方程式為
。(4)反應④是氨基上的氫原子被取代,反應的化學方程式為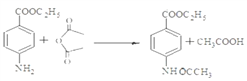 。(5) ①苯環上有兩個取代基,其中一個為氨基(—NH2)且與苯環直接相連;②能發生水解反應,說明含有酯基,則酯基可以是-OOCCH2CH3或-CH2OOCCH3或-CH2CH2OOCH或-CH(CH3)OOCH或-COOCH2CH3或-CH2COOCH3,均有鄰間對三種,除去Y以外還有17種;其中能發生銀鏡反應且核磁共振氫譜中峰最少的同分異構體的結構簡式為
。(5) ①苯環上有兩個取代基,其中一個為氨基(—NH2)且與苯環直接相連;②能發生水解反應,說明含有酯基,則酯基可以是-OOCCH2CH3或-CH2OOCCH3或-CH2CH2OOCH或-CH(CH3)OOCH或-COOCH2CH3或-CH2COOCH3,均有鄰間對三種,除去Y以外還有17種;其中能發生銀鏡反應且核磁共振氫譜中峰最少的同分異構體的結構簡式為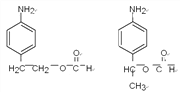 。(6)可以首先氧化甲基,然后酯化,最后還原硝基為氨基,即
。(6)可以首先氧化甲基,然后酯化,最后還原硝基為氨基,即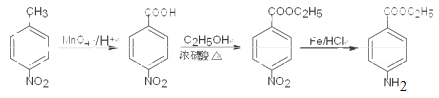 。
。


 互動課堂系列答案
互動課堂系列答案 激活思維智能訓練課時導學練系列答案
激活思維智能訓練課時導學練系列答案科目:高中化學 來源: 題型:
【題目】下列關于合金的敘述中正確的是( )
A. 日常生活中用到的五角硬幣屬于銅合金
B. 低碳鋼比中碳鋼強度高
C. 合金在任何情況都比單一金屬性能優良
D. 合金是由兩種或多種金屬熔合而成的
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用化學反應原理研究NH3的性質具有重要意義。請回答下列問題:
(1)已知:①NH3 (g)+3O2(g)=2N2(g)+6H2O(g) △H=-1266.5kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H=+180.5 kJ·mol-1
寫出氨高溫催化氧化生成NO的熱化學方程式___________。
(2)氨氣、空氣可以構成燃料電池,其電池反應原理為:4NH3+302=2N2+6H2O。已知電解質溶液為KOH溶液,則負極的電極反應式為________。
(3)合成氨技術的創立開辟了人工固氮的重要途徑,其研究來自正確的理論指導,合成氨反應的化學平衡常數K值和溫度的關系如下:

由上表數據可知該反應的△H_______ 0 填“> ”、“< ”或“=”) ;
理論上,為了增大平衡時H2的轉化率,可采取的措施是_______(選填字母);
A.增大壓強 B.使用合適的催化劑 C.升高溫度 D.及時分離出產物中的NH3
③400℃時,測得某時刻氨氣、氮氣、氫氣的物質的量濃度分別為3mol·L-1、2 mol·L-1、l mol·L-1,此時刻該反應的V正(N2)=______ V逆(N2)。(填“>”、“<”或“=”)。
(4)已知25℃時,Ksp[Fe(OH)3]=1.0×l0-38, Ksp[Al(OH)3]=3.0×l0-34,當溶液中的金屬離子濃度小于1.0×10-5mol·L-1時,可以認為沉淀完全。在含Fe3+、A13+的濃度均為1. 05mol·L-1的溶液中加入氨水,當Fe3+完全沉淀時,A13+沉淀的百分數____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三室式電滲析法處理含Na2SO4廢水的原理如圖所示,采用惰性電極,ab、cd均為離子交換膜,在直流電場的作用下,兩膜中間的Na+和S![]() 可通過離子交換膜,而兩端隔室中離子被阻擋不能進入中間隔室。下列敘述正確的是 ( )
可通過離子交換膜,而兩端隔室中離子被阻擋不能進入中間隔室。下列敘述正確的是 ( )
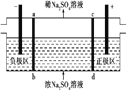
A. 通電后中間隔室的S![]() 離子向正極遷移,正極區溶液pH增大
離子向正極遷移,正極區溶液pH增大
B. 當電路中通過1 mol電子的電量時,會有0.5 mol的O2生成
C. 負極反應為2H2O-4e-![]() O2+4H+,負極區溶液pH降低
O2+4H+,負極區溶液pH降低
D. 該法在處理含Na2SO4廢水時可以得到NaOH和H2SO4產品
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】熟石灰在生產和生活中有廣泛的用途。請回答:
(1)熟石灰中金屬元素的原子結構示意圖是_____。
(2)區分熟石灰溶液、氯化鈉溶液、稀硫酸的操作及現象是__________。
(3)用石灰漿粉刷墻壁,干燥后墻面變硬,反應的化學方程式是_____。
(4)某地區土壤呈酸性(含硫酸),可選用熟石灰來改良,則反應的化學方程式是_________。
(5)用熟石灰粉與草木灰按一定比例混合可制得高效環保農藥“黑白粉”。使用時,選擇在有露 水的早晨,把“黑白粉”撒在植物莖葉上,可消除忌堿蟲體。
①“黑白粉”比熟石灰更高效,是由于生成了堿性更強的物質,該反應的化學方程式是________。
②“黑白粉”中可提供植物生長和抗倒伏的營養元素是_____(填元素符號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種黑色粉末氧化銅、氧化亞鐵、二氧化錳、石墨粉,只需加入一種試劑即可將它們區別開來, 這種試劑是( )
A. 氫氧化鈉溶液 B. 稀硫酸
C. 濃鹽酸 D. 蒸餾水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于硅酸的說法正確的是( )
A. 硅酸是一種不溶于水的含氧酸 B. 硅酸不溶于水,是一種非電解質
C. 硅酸的酸性比碳酸強 D. 硅酸可由二氧化硅與水反應制得
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com