
【題目】過氧化氫是一種綠色氧化劑、還原劑,工業上有多種方法制備H2O2。
(1)①研究表明,H2O2相當于二元弱酸,則它的一級電離方程式為_______________,已知常溫下1 L的H2O2相當于48.3 mol,其K1≈1.67×10-12。則該溫度下H2O2中c(H+)約為__________,寫出它與足量Ba(OH)2反應的化學方程式:_____________。
②乙基蒽醌法是制備過氧化氫最常用的方法,其主要過程可以用下圖表示,寫出此過程的總化學方程式:___________________________________________。

③空氣陰極法制備H2O2是一種環境友好型、節能型制備方法,電解總方程式為3H2O+3O2![]() 3H2O2+O3,則陽極上電極反應式為________________________。
3H2O2+O3,則陽極上電極反應式為________________________。
(2)氧也能與鉀元素形成K2O、K2O2、KO2、KO3等氧化物,其中KO2是一種比Na2O2效率高的供氧劑,寫出它與CO2反應的化學方程式:__________________________。
【答案】 H2O2![]() H++HO
H++HO![]() 9×10-6 mol·L-1 Ba(OH)2+H2O2===2H2O+BaO2 H2+O2
9×10-6 mol·L-1 Ba(OH)2+H2O2===2H2O+BaO2 H2+O2![]() H2O2 2H2O-2e-===H2O2+2H+ 4KO2+2CO2===2K2CO3+3O2
H2O2 2H2O-2e-===H2O2+2H+ 4KO2+2CO2===2K2CO3+3O2
【解析】(1)①雙氧水可以可作是二元弱酸,說明雙氧水分子能發生兩步電離,第一步電離出一個氫離子,則它的一級電離方程式為H2O2H++HO2-;根據K=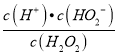 =1.67×10 -12,則c(H+)=
=1.67×10 -12,則c(H+)=![]() =9×10-6mol/L;H2O2與Ba(OH)2作用形成正鹽為BaO2,同時生成水,其反應的方程式為:H2O2+Ba(OH)2=BaO2+2H2O;故答案為:H2O2
=9×10-6mol/L;H2O2與Ba(OH)2作用形成正鹽為BaO2,同時生成水,其反應的方程式為:H2O2+Ba(OH)2=BaO2+2H2O;故答案為:H2O2![]() H++HO2-;9×10-6mol/L;H2O2+Ba(OH)2=BaO2+2H2O;
H++HO2-;9×10-6mol/L;H2O2+Ba(OH)2=BaO2+2H2O;
②通過圖示可知,用乙基蒽醌作催化劑制取雙氧水,反應為:H2+O2![]() H2O2,故答案為:H2+O2
H2O2,故答案為:H2+O2![]() H2O2;
H2O2;
③電解總方程式3H2O+3O2![]() 3H2O2+O3,水在陽極上失電子生成雙氧水,其電極方程式:2H2O-2e-=H2O2+2H+,故答案為:2H2O-2e-=H2O2+2H+;
3H2O2+O3,水在陽極上失電子生成雙氧水,其電極方程式:2H2O-2e-=H2O2+2H+,故答案為:2H2O-2e-=H2O2+2H+;
(2)過氧化鈉和二氧化碳反應生成碳酸鈉和氧氣,則超氧化鉀和二氧化碳反應生成碳酸鉀和氧氣,反應方程式為4KO2+2CO2=2K2CO3+3O2,故答案為:4KO2+2CO2=2K2CO3+3O2。


科目:高中化學 來源: 題型:
【題目】無機化學命名委員會(國際組織)在1999年作出決定,把長式周期表原先的主副族序號取消,由左到右按原順序編為18列,按這個規定,下列說法正確的是
A. 第一列的元素都是金屬元素
B. 第三列所含的元素種類最多
C. 第18列元素原子的最外層電子數均為8
D. 只有第二列元素的最外層電子數為2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中屬吸熱反應的是
A.鋁與鹽酸反應放出氫氣 B.氫氧化鈉與鹽酸的反應
C.硫在空氣或氧氣中燃燒 D.Ba(OH)2·8H2O與NH4Cl反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化氫的水溶液俗稱雙氧水,它的用途很廣,常用于消毒、殺菌、漂白等。試回答下列問題:
(1)過氧化氫含有的化學鍵為______________。
(2)Na2O2、K2O2以及BaO2都可與酸作用生成過氧化氫,目前實驗室制取過氧化氫溶液可取上述某種過氧化物與適量稀硫酸作用,然后經________操作即可制得,則上述最適合的過氧化物是__________。
(3)幾乎所有古代藝術家的油畫都是以鉛白2PbCO3·Pb(OH)2為底色,但若空氣中含H2S氣體,鉛白就會變黑,可以用H2O2將黑色物質氧化成顏色相近的PbSO4而修復,寫出鉛白在空氣中變黑的化學方程式:____________________________________________。
(4)甲酸鈣[Ca(HCOO)2]廣泛用于食品工業生產上,實驗室制取甲酸鈣的方法之一是將氫氧化鈣和甲醛溶液依次加入到質量分數為30%~70%的過氧化氫溶液中,則該反應的化學方程式為______________,過氧化氫比理論用量稍多,其目的是______________。反應溫度最好控制在30~70 ℃,溫度不宜過高,其主要原因是_________________。
(5)過氧化氫與碳酸鈉的加合物 Na2CO3·xH2O2比較穩定,方便儲存,可用于消毒、漂白,現稱取100 g Na2CO3·xH2O2晶體加熱,實驗結果如圖所示,則該晶體的組成為______________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將除去表面氧化膜的Al、Cu片插入濃HNO3中組成原電池(圖1),測得原電池的電流強度(I)隨時間(t)的變化如圖2所示,下列說法正確的是

A. 0-t1時,原電池的負極是銅片
B. 0-t1時,正極的電極反應式是2H++2e-=H2↑
C. t1時刻,電流方向發生變化的原因是Al 在濃硝酸中發生鈍化,氧化膜阻止了Al進一步反應
D. tl時刻后,電子從鋁經過導線流向銅
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值,下列說法中不正確的是( )
A. 0.5 mol H2O所含的電子數為5NA
B. 1 mol NH4+ 所含質子數為10NA
C. 標準狀況下,22.4 L CO2所含的分子數為NA
D. 常溫常壓下,32 g O2和O3的混合氣體所含氧原子數為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向50 mL稀H2SO4與稀HNO3的混合溶液中逐漸加入鐵粉,假設加入鐵粉的質量與產生氣體的體積(標準狀況)之間的關系如下圖所示,且每一段只對應一個反應。下列說法正確的

A. 開始時產生的氣體為H2
B. AB段產生的反應為置換反應
C. 所用混合溶液中c(HNO3)=0.5mol·L-1
D. 參加反應鐵粉的總質量m2=5.6 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知NA為阿伏加德羅常數的數值,下列說法正確的是
A. 56g鐵在足量氧氣中燃燒,轉移的電子數為2NA
B. lg氫氣含有NA個氫氣分子
C. 標準狀況下,22.4L水含有1mol水分子
D. 2mol鈉與過量稀鹽酸反應生成NA個氫氣分子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com