
| A.伴有能量變化的物質變化都是化學變化 | B.物質發生化學反應一定伴隨著能量變化 |
| C.吸熱反應在常溫下不能發生 | D.放熱反應的發生無需任何條件 |
 鴻圖圖書寒假作業假期作業吉林大學出版社系列答案
鴻圖圖書寒假作業假期作業吉林大學出版社系列答案科目:高中化學 來源:不詳 題型:單選題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常數為K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常數為K;| 溫度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
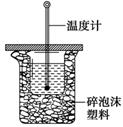
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題


查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題

| A.已知CO的燃燒熱為283 kJ/mol,2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,則圖甲表示CO和H2O(g)生成CO2和H2的能量變化 |
| B.某溫度下,pH=11的NH3·H2O和pH=1的鹽酸等體積混合后(不考慮混合后溶液體積的變化)恰好完全反應,反應后的溶液中NH4+ 、NH3·H2O與NH3三種微粒的平衡濃度之和為0.05 mol·L-1 |
| C.在常溫下,X2(g)和H2反應生成HX的平衡常數如表所示,僅依據K的變化,就可以說明在相同條件下,平衡時X2(從F2到I2)的轉化率逐漸降低,且X2與H2反應的劇烈程度逐漸減弱 |
D.圖乙中曲線表示常溫下向弱酸HA的稀溶液中加水稀釋過程中, 的變化情況 的變化情況 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
A.已知H2(g)+ O2(g)===H2O(g) ΔH1=a kJ·mol-1; O2(g)===H2O(g) ΔH1=a kJ·mol-1;2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ·mol-1,則a>b |
| B.CO的燃燒熱為283.0 kJ·mol-1,則 2CO2(g)===2CO(g)+O2(g) ΔH=+566.0 kJ·mol-1 |
C.若N2(g)+3H2(g)  2NH3(g) ΔH=-d kJ·mol-1,故在某容器中投入1 mol N2與3 mol H2充分反應后,放出的熱量小于d kJ 2NH3(g) ΔH=-d kJ·mol-1,故在某容器中投入1 mol N2與3 mol H2充分反應后,放出的熱量小于d kJ |
| D.HCl和NaOH反應的中和熱ΔH=-57.3 kJ·mol-1,則H2SO4和KOH反應的中和熱ΔH=-114.6 kJ·mol-1 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-1068 kJ/mol |
| B.肼是與氨類似的弱堿,它易溶于水,其電離方程式:N2H4 + H2O=N2H5++ OH- |
| C.鉑做電極,以KOH溶液為電解質溶液的肼—空氣燃料電池,放電時的負極反應式:N2H4-4e-+4OH-=N2↑+4H2O |
| D.鉑做電極,以KOH溶液為電解質溶液的肼—空氣燃料電池,工作一段時間后,KOH溶液的pH將增大 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 2SO3(g);△H=-197kJ·mol-1。現有同一溫度下的三個體積相同的密閉容器,在第一個容器中通入2molSO2和1molO2,達到平衡時,反應放出的熱量為Q1;向第二個密閉容器中通入1molSO2和0.5molO2,達到平衡時放出的熱量為Q2;在第三個密閉容器中通入1molSO2、0.5molO2和1molSO3達到平衡時放出的熱量為Q3。下列關系正確的是
2SO3(g);△H=-197kJ·mol-1。現有同一溫度下的三個體積相同的密閉容器,在第一個容器中通入2molSO2和1molO2,達到平衡時,反應放出的熱量為Q1;向第二個密閉容器中通入1molSO2和0.5molO2,達到平衡時放出的熱量為Q2;在第三個密閉容器中通入1molSO2、0.5molO2和1molSO3達到平衡時放出的熱量為Q3。下列關系正確的是| A.Q1=Q3=197kJ | B.Q1=Q3<197kJ |
| C.Q1=2Q2 <197kJ | D.Q2<Q1<197kJ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com