
【題目】當今環境保護越來越受重視,某化工集團為減少環境污染,提高資源的利用率、將鈦廠、氯堿廠、甲醇廠進行聯合生產。其主要生產工藝如下:(FeTiO3中Ti為+4價)

下列敘述正確的是
A. 該流程中只有“電解”、“氯化”涉及氧化還原反應
B. “氯化”時每消耗36g焦炭,則轉移7mol電子
C. “合成”反應中氧化劑與還原劑的物質的量之比為1:1
D. 上述流程中“Mg,Ar"可用“Mg,CO2”代替
【答案】B
【解析】
食鹽水經過電解2Cl-+2H2O![]() C12↑+ H2↑+ 2OH-,產生燒堿、氯氣和氫氣。氫氣與一氧化碳化合產生甲醇,氯氣與鈦鐵礦和碳反應產生氯化鐵,一氧化碳和氯化鈦,氯化鈦與單質鎂在高溫下發生置換反應,產生鈦單質。
C12↑+ H2↑+ 2OH-,產生燒堿、氯氣和氫氣。氫氣與一氧化碳化合產生甲醇,氯氣與鈦鐵礦和碳反應產生氯化鐵,一氧化碳和氯化鈦,氯化鈦與單質鎂在高溫下發生置換反應,產生鈦單質。
A. 該流程中所有反應均涉及氧化還原反應,A錯誤;
B. “氯化”反應,7Cl2+2FeTiO3+6C=6CO+2TiCl4+2FeCl3,每消耗36g焦炭即3mol,則轉移7mol電子,B正確;
C. 合成反應中CO+2H2=CH3OH,氧化劑為一氧化碳,還原劑為氫氣,物質的量之比為1:2,C錯誤;
D. Mg與CO2反應產生碳單質,本反應實質是氯化鈦和鎂的反應,氦氣提供穩定環境,二氧化碳干擾實驗產物,引入雜質,D錯誤;
答案為B。


科目:高中化學 來源: 題型:
【題目】已知25℃時部分弱電解質的電離平衡常數數據如表所示:
化學式 | CH3COOH | H2CO3 | HClO | |
電離平衡常數 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列問題:
(1)物質的量濃度均為0.1mol·L-1的四種溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的順序是________(用字母編號填寫)。
(2)常溫下,0.1mol·L-1 CH3COOH溶液加水稀釋過程中,下列表達式的數據變大的是___(填字母)。
A.c(H+)
B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-)
D.c(OH-)/c(H+)
E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)體積均為100mL pH=2的CH3COOH與一元酸HX,加水稀釋過程中pH與溶液體積的關系如圖所示,則HX的電離平衡常數________(填“大于”、“小于”或“等于”)CH3COOH的電離平衡常數。
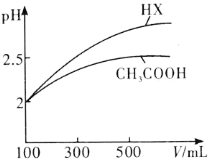
(4)標準狀況下,將1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,用溶液中微粒的濃度符號完成下列等式:
①c(OH-)=2c(H2CO3)+________;
②c(H+)+c(Na+)=________。
(5)25℃時,CH3COOH與CH3COONa的混合溶液,若測得pH=6,則溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精確值)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯乙烷(C8H10)可生產塑料單體苯乙烯(C8H8),其反應原理是C8H10(g)![]() C8H8(g)+H2(g) ΔH=+125kJ·mol-1。某溫度下,將0.40mol苯乙烷,充入2L真空密閉容器中發生反應,測定不同時間該容器內物質的量,得到數據如下表:
C8H8(g)+H2(g) ΔH=+125kJ·mol-1。某溫度下,將0.40mol苯乙烷,充入2L真空密閉容器中發生反應,測定不同時間該容器內物質的量,得到數據如下表:
時間/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)當反應進行到20min時,該段時間內H2的平均反應速率是________。
(2)該溫度下,該反應的化學平衡常數是________(保留兩位有效數字)。
(3)若保持其他條件不變,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),當有30kJ熱量放出時,該反應中H2的轉化率是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出下列反應的熱化學方程式:
(1)1 mol C2H5OH(l)完全燃燒生成CO2(g)和H2O(l),放出1 366.8 kJ熱量:________________________________________________________________________
(2)1.7 g NH3(g)發生催化氧化反應生成氣態產物,放出22.67 kJ的熱量:________________________________________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用石墨作電極電解下列溶液①稀H2SO4 ②K2SO4溶液 ③CuCl2溶液 ④CuSO4溶液 ⑤KOH溶液
(1)陰極、陽極都有氣體產生,且體積比(相同條件下)為2∶1的是(填序號)__________,其陽極的電極反應式都是_________________________________________________,
陰極的電極反應式都是_________________________________________________,
總反應的化學方程式都是_________________________________________________。
(2)陰極、陽極都有氣體產生,其中溶液酸性增強的是____________________。 (填序號)。
(3)一個電極析出金屬,另一個電極逸出刺激性氣味氣體的是_______(填序號),
其陽極的電極反應式是___________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列是含碳元素的物質:①石墨,②一氧化碳,③干冰,④碳酸,⑤碳酸鈣,⑥乙醇。其中屬于單質的是______(填序號,下同);屬于酸性氧化物的是______;屬于鹽的是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A、B、C為中學化學中常見的單質。室溫下,A為固體,B和C均為氣體。在適宜的條件下,它們可以按如圖進行反應。下列說法中正確的是
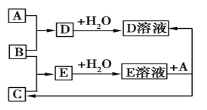
A. A、B、C中三種元素的任意兩種元素形成的化合物所屬物質類別可能是氧化物
B. A、B、C中有一種金屬且為B
C. 如果E溶液是一種強酸,則E溶液為硫酸
D. A、B、C中三種元素的任意兩種元素形成的化合物所屬物質類別一定不是堿
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,將1.00molN2(g)與3.00molH2(g)混合于一個10.0L密閉容器中,在不同溫度下達到平衡時NH3(g)的平衡濃度如圖所示。其中溫度為T1時平衡混合氣體中氨氣的體積分數為25.0%。
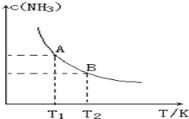
(1)當溫度由T1變化到T2時,平衡常數關系K1___________K2(填“>”,“<”或“=”),焓變△H___________0(填“>”或“<”)。
(2)該反應在T1溫度下5.0min達到平衡,這段時間內N2的化學反應速率為_________,N2的轉化率___________。
(3)T1溫度下該反應的化學平衡常數K1=______________。
(4)T1溫度時,若測得高爐中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L,在這種情況下,該反應是否處于平衡狀態___________(填是或否),此時反應速率是v正___________v逆(填>,<,=)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com