
【題目】乙炔加氫是乙烯工業中的重要精制反應,利用這一反應可以將乙烯產品中的乙炔含量降低,以避免后續乙烯聚合催化劑的中毒,工業上稱為碳二加氫過程。
已知:Ⅰ.CH![]() CH(g)+H2(g)→CH2=CH2(g) ΔH1 K1(400K)=4.2×1022
CH(g)+H2(g)→CH2=CH2(g) ΔH1 K1(400K)=4.2×1022
Ⅱ.CH![]() CH(g)+2H2(g)→CH3CH3(g) ΔH2=-311.4kJ·mol-1 K2(400K)=1.4×1038
CH(g)+2H2(g)→CH3CH3(g) ΔH2=-311.4kJ·mol-1 K2(400K)=1.4×1038
回答下列問題:
(1)已知幾種化學鍵的鍵能如下表所示:
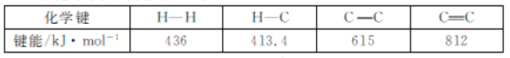
△H1=___kJmol-1。
(2)400K時,在密閉容器中將等物質的量的CH2=CH2(g)和H2(g)混合,采用適當的催化劑進行反應,生成CH3CH3(g),達到平衡時測得![]() =1016,則平衡時c(H2)=___molL-1。
=1016,則平衡時c(H2)=___molL-1。
(3)據前人研究發現乙炔在PV團簇表面催化加氫反應的部分歷程如圖1所示,其中吸附在PV表面上的物種用*標注。

推測乙烯在PV表面上的吸附為___(填“放熱”或“吸熱”)過程。圖1歷程中最大能金(活化能)E正=___kJ·mol-1,該步驟的化學方程式為___。
(4)T1℃時,將體積比為1:2的CH≡CH(g)和H2(g)充入剛性密閉容器中,加入催化劑發生反應Ⅱ,起始體系總壓強為P0 kPa,實驗測得H2的分壓(p)與反應時間(t)的關系如圖2所示。
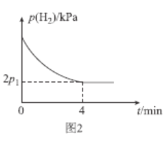
①T1℃時,0~4min內,平均反應速率v(HC≡CH)=___kPamin-1(用含p0、p1的代數式表示,下同)。
②T1℃時,該反應的化學平衡常數Kp=___kPa-2(Kp為以分壓表示的平衡常數,分壓=總壓×物質的量分數)。
③T1℃時,0~2min內p(H2)的減小量___(填“>”“<”或“=”)2~4min內p(H2)的減小量,理由為___。
【答案】-193.8 3 放熱 22.59 C2H3+ H= C2H4+ ![]()
![]() > 反應物的濃度減小,反應速率減慢
> 反應物的濃度減小,反應速率減慢
【解析】
(1)結合表格中鍵能數據,根據△H=反應物的鍵能 -生成物的鍵能進行解答;
(2)運用蓋斯定律解出目標反應,根據已知反應與目標反應的平衡常數關系計算;
(3)結合圖中各物質反應關系中反應物生成物能量變化分析判斷;
(4)利用“三段式計算”反應速率、平衡常數;反應過程中反應物的濃度變化分析;
(1)根據△H=反應物的鍵能 -生成物的鍵能,則ΔH1=413.4 kJmol-1×2+812 kJmol-1+436 kJmol-1-(413.4 kJmol-1×4+615 kJmol-1)=-193.8 kJmol-1;
(2)已知:Ⅰ.CH![]() CH(g)+H2(g)→CH2=CH2(g) ΔH1 K1(400K)=4.2×1022
CH(g)+H2(g)→CH2=CH2(g) ΔH1 K1(400K)=4.2×1022
Ⅱ.CH![]() CH(g)+2H2(g)→CH3CH3(g) ΔH2=-311.4kJ·mol-1 K2(400K)=1.4×1038
CH(g)+2H2(g)→CH3CH3(g) ΔH2=-311.4kJ·mol-1 K2(400K)=1.4×1038
根據蓋斯定律,Ⅱ-Ⅰ得:CH2=CH2(g)+H2(g)→CH3CH3(g),平衡時測得![]() =1016,平衡常數K=
=1016,平衡常數K=![]() =
=![]() =
=![]() ,則c(H2)=3mol/L;
,則c(H2)=3mol/L;
(3)如圖1所示,IM6為C2H4,C2H4→C2H4的過程為乙烯的脫附過程,需要吸收14.58 kJmol-1的能量,則反之C2H4→C2H4的過程為乙烯的吸附過程,放出14.58 kJmol-1的能量;如圖所示,IM4→IM5過程中活化能最大,為-32.33 kJmol-1-(-54.92 kJmol-1)=22.59 kJmol-1,該步驟的化學反應方程式為:C2H3+ H= C2H4+ ;
(4)①根據反應:CH![]() CH(g)+2H2(g)→CH3CH3(g),如圖所示,開始時p(CH
CH(g)+2H2(g)→CH3CH3(g),如圖所示,開始時p(CH![]() CH)=
CH)=![]() kPa,p(H2)=
kPa,p(H2)=![]() kPa,根據“三段式”:
kPa,根據“三段式”:

則2x=![]() -
-![]() ,解得x=
,解得x=![]() - p1,故0-4min內,平均反應速率v(HC≡CH)=
- p1,故0-4min內,平均反應速率v(HC≡CH)=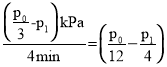 kPamin-1;
kPamin-1;
②由①的“三段式”可得Kp=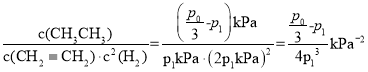 ;
;
③隨著反應的進行,反應物的濃度減小,反應速率減慢,則0~2min內氫氣的變化量大于2~4min內,則0~2min內p(H2)的減小量>2~4min內p(H2)的減小量。


科目:高中化學 來源: 題型:
【題目】下列溶液中各微粒的濃度關系一定正確的是( )
A.25℃時,pH均為10的氨水與 Ba(OH)2 溶液中,溶質的物質的量濃度之比為1:2
B.某溫度下,0.1mol·L1 NaHCO3溶液的pH=8,則 c(OH)=106mol·L1
C.0.1mol·L1的HA溶液的pH=2,溶液中c(H+)=c(OH)+c(A)
D.pH=9的CH3COONa溶液與pH=9的氨水中,水電離出的c(OH)之比為1:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向20 mL 0.1 molL-1的MOH溶液中逐滴加入0.1 molL-1 HCl溶液,滴定曲線如圖所示。請回答下列問題:
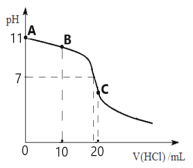
(1)請寫出MOH的電離方程式__________________________,常溫下,該堿的電離平衡常數Kb=_________。
(2)滴定到B點時,溶液中各離子濃度由大到小的順序是_________________________。
(3)C點所對應的溶液呈_____性,用離子方程式表示其原因______________________。
(4)圖中A、B、C三點溶液中水的電離程度由大到小的順序是_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO、H2是煤的氣化產物,在生產生活中用途廣泛。
(1)CO還原法處理大氣污染物SO2
①2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,該反應的平衡常數表達式為__。
S(s)+2CO2(g) H = -270 kJ·mol-1,該反應的平衡常數表達式為__。
②在絕熱恒容的密閉容器中進行上述反應,下列說法正確的是_____。
a 若混合氣體密度保持不變,則已達平衡狀態
b 達平衡后若再充人一定量CO2,平衡常數保持不變
c 分離出部分S,正、逆反應速率均保持不變,平衡不移動
d 從反應開始到平衡,容器內氣體的壓強保持不變
③向2 L恒溫恒容密閉容器中通人2 mol CO、1 mol SO2,分別進行a、b、c三組實驗。在不同催化劑件下發生反應:2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,反應體系總壓隨時間的變化如下表所示,則三組實驗溫度的大小關系是_____(用a、b、c表示),實驗a從反應開始至45s達到平衡,則該過程反應速率v(SO2)__________(結果保留2位有效數字)。
S(s)+2CO2(g) H = -270 kJ·mol-1,反應體系總壓隨時間的變化如下表所示,則三組實驗溫度的大小關系是_____(用a、b、c表示),實驗a從反應開始至45s達到平衡,則該過程反應速率v(SO2)__________(結果保留2位有效數字)。
| 0s | 40s | 45s | 60s |
a | 175 | 142 | 140 | 140 |
b | 160 | 120 | 120 | 120 |
c | 160 | 130 | 125 | 120 |
(2)利用CO、H2可制備天然氣,主要反應為:
CO(g) + 3H2(g) ![]() CH4(g) + H2O(g) H1=-206.2 kJ·mol1;
CH4(g) + H2O(g) H1=-206.2 kJ·mol1;
CO(g) + H2O(g) ![]() CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
H2O(l) ═H2O(g) H3 =+44 kJ·mol-1 。
回答下列問題:
①反應CO2(g) + 4H2(g) ![]() CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某溫度下,分別在起始容積相同的恒壓容器A、恒容容器B中加人1molCO2和4molH2的混合氣體,兩容器反應達到平衡后放出或吸收的熱量較多的是__( 填“A”或“B")。
CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某溫度下,分別在起始容積相同的恒壓容器A、恒容容器B中加人1molCO2和4molH2的混合氣體,兩容器反應達到平衡后放出或吸收的熱量較多的是__( 填“A”或“B")。
②在恒壓管道反應器中按n(H2):n(CO) = 3:1通入原料氣,在催化劑作用下制備合成天然氣,400 ℃ p總為100 kPa時反應體系平衡組成如下表所示:
組分 | CH4 | H2O | H2 | CO2 | CO |
體積分數/% | 45.0 | 42.5 | 10.0 | 1.50 | 1.00 |
則該條件下CO的總轉化率α=____。![]()
③制備合成天然氣采用在原料氣中通入水蒸氣來緩解催化劑積碳。
積碳反應為:反應I :CH4(g) ![]() C(s) + 2H2(g) H = +75 kJ·mol-1;
C(s) + 2H2(g) H = +75 kJ·mol-1;
反應Ⅱ:2CO(g) ![]() C(s) + CO2(g) H = -172 kJ·mol-1,
C(s) + CO2(g) H = -172 kJ·mol-1,
平衡體系中水蒸氣濃度對積碳量的影響如圖所示,下列說法正確的是__。
A 曲線1在700 ~ 800℃積碳量減小的原因可能是反應Ⅱ逆向移動
B 曲線1在550 ~700℃積碳量增大的原因可能是反應I、Ⅱ的速率增大
C 曲線2、3在550 ~800℃積碳量較低的原因是水蒸氣稀釋作用使積碳反應速率減小
D 水蒸氣能吸收反應放出的熱量,降低體系溫度至550℃以下,有利于減少積碳

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃煤脫硫的反應為2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) △H<0。500℃時,實驗測得在2L剛性密閉容器中該反應在不同時刻O2、CO2的物質的量(或物質的量濃度)如下表所示,下列判斷正確的是( )
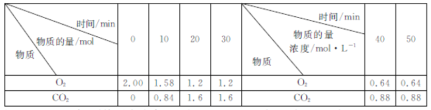
A.0~10min內,平均反應速率v(SO2)=0.084mol·L-1·min-1
B.30min后,改變的條件只能是增大O2的通入量
C.若容器絕熱,則20min時,![]() >
>![]()
D.化學平衡常數:30min<40min
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物H是C5a受體拮抗劑W-54011的中間體,Nakamura等人設計制備H的合成路線如圖所示:
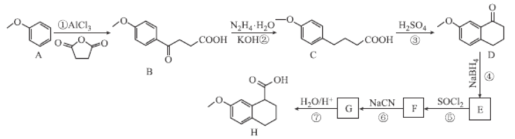
已知:Ⅰ.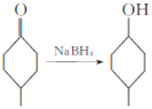 ;
;
Ⅱ.R-CN![]() R-COOH。
R-COOH。
回答下列問題:
(1)B中含氧官能團的名稱為___。
(2)F的分子式為C13H13OCl,則F的結構簡式為___。
(3)②⑤的反應類型分別為___、___。
(4)反應①的化學方程式為___。
(5)碳原子上連有4個不同的原子或基團時,該碳稱為手性碳,寫出化合物H與足量H2發生加成反應的產物的結構簡式___,并用星號(*)標出其中的手性碳:
(6)Q與C互為同分異構體,Q遇FeCl3溶液發生顯色反應,且苯環上連有兩個取代基,1molQ與足量NaHCO3溶液反應最多產生1molCO2,則Q的同分異構體有___種(不含立體異構)其中核磁共振氫譜有6組吸收峰的結構簡式為___(任寫一種)。
(7)參照上述合成路線和信息,設計以苯乙醛為原料(其它試劑任選),制備![]() 的合成路線:___。
的合成路線:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗方法和結論都正確的是
A.酸堿中和滴定時,錐形瓶需用待測液潤洗2次,再加入待測液
B.檢驗蔗糖水解產物具有還原性:在蔗糖水解后的溶液中先加入適量稀NaOH溶液中和,再加入新制的銀氨溶液并水浴加熱
C.圖中酸式滴定管讀數為12.20 mL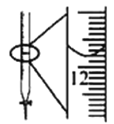
D.若用已知濃度的KMnO4溶液去測定某溶液中Fe2+濃度,KMnO4溶液放在堿式滴定管中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來,冠以“綠色”的新概念不斷產生,如綠色食品、綠色材料、綠色能源、綠色化學等,這里的“綠色”是對人類社會可持續發展戰略的形象表述。“綠色化學”要求從經濟、環保和技術上設計可行的化學反應。據此,由單質鎂制硝酸鎂的下列4個方案中,你認為可行而且符合“綠色化學”要求的方案是( )
A.![]()
B.![]()
C.Mg![]() MgO
MgO![]() Mg(NO3)2
Mg(NO3)2
D.![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,向10 mL 0.1 mol/L醋酸溶液中加水稀釋后,下列說法正確的是( )
A.溶液中粒子的數目減小
B.再加入CH3COONa固體能促進醋酸的電離
C.醋酸的電離程度增大,c(H+)亦增大
D.溶液中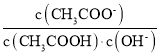 不變
不變
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com