
【題目】下列說法正確的是( )
A. 在粗硅的制取中發(fā)生2C+SiO2![]() 2CO↑+Si,硅被還原,所以碳的還原性強于硅的還原性
2CO↑+Si,硅被還原,所以碳的還原性強于硅的還原性
B. 盛放NaOH溶液時,使用帶玻璃塞的磨口瓶
C. 用SiO2制取硅酸,應先使二氧化硅與氫氧化鈉溶液反應,然后再通入CO2
D. 由Na2CO3+SiO2![]() Na2SiO3+CO2↑可知,硅酸的酸性強于碳酸
Na2SiO3+CO2↑可知,硅酸的酸性強于碳酸
【答案】C
【解析】
A、依據元素周期律,硅的還原性大于碳,上述反應能發(fā)生是因為產物中有CO氣體生成,使平衡向右移動,故A錯誤;
B、磨口玻璃塞中玻璃成分二氧化硅能和氫氧化鈉反應,生成具有粘性的硅酸鈉,造成玻璃塞和瓶體粘在一起,不便于打開,所以盛放氫氧化鈉溶液時,不可以用玻璃瓶塞,故B錯誤;
C、二氧化硅難溶于水,所以無法用二氧化硅和水直接反應制得,用SiO2制取硅酸,先使二氧化硅與氫氧化鈉溶液反應,SiO2+2NaOH=Na2SiO3+H2O,因碳酸酸性強于硅酸且硅酸溶解度較小的沉淀,所以通入CO2,發(fā)生Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,制得硅酸,故C正確;
D、反應不是在水溶液中進行的,且產物中有氣體生成,與酸性強弱無關,一般在溶液中強酸可制得弱酸,即硅酸鈉溶液中通入CO2,制得硅酸說明碳酸酸性強于硅酸,故D錯誤。
故選C。


科目:高中化學 來源: 題型:
【題目】溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的幾種。①若加入鋅粒,產生無色無味的氣體;②若加入NaOH溶液,產生白色沉淀,且產生的沉淀量與加入NaOH的物質的量之向的關系如圖所示。則下列說法正確的是( )
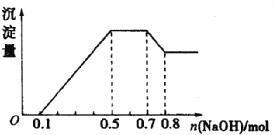
A. 溶液中的陽離子一定含有H+、Mg2+、Al3+,可能含有Fe3+
B. 溶液中c(NH4+)=0.2mol/L
C. 溶液中一定不含CO32-和NO3-,一定含有SO42-
D. c(H+):c(Al3+):c(Mg2+)=1:1:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于元素周期表中元素分布的描述,正確的是
A. 周期表中的主族都有非金屬元素
B. 周期表中的主族都有金屬元素
C. 周期表中的金屬元素都位于長周期
D. 周期表中的非金屬元素都位于主族和0族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨是重要的工業(yè)原料,在農業(yè)、醫(yī)藥、國防和化工等領域有重要應用。
Ⅰ.常溫下向100mL0.2mol·L-l的氨水中逐滴加入0.2mol·L-1的鹽酸,所得溶液的pH、溶液中NH4+和NH3·H2O物質的量分數與加入鹽酸的體枳的關系如圖所示,根據圖象回答下列問題。
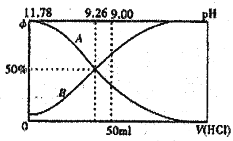
(1)表示NH3·H2O濃度變化的曲銭是____________(填“A”或“B”)。
(2)NH3·H2O的電離常數為____________(已知lg1.8=0.26)。
(3)當加入鹽酸體積為50mL時,溶液中c(NH4+)·c(NH3·H2O)=____________mol·L-1(用數字表示精確值)。
Ⅱ.若液氨中也存在類似水的電離(H2O+H2O![]() H3O++OH-),碳酸鈉溶于液氨后也能發(fā)生完全電離和類似水解的氨解。
H3O++OH-),碳酸鈉溶于液氨后也能發(fā)生完全電離和類似水解的氨解。
(1)寫出液氨的電離方程式__________________________。
(2)寫出碳酸鈉溶于液氨后第一級氨解的離子方程式____________________________________。
(3)寫出碳酸鈉的液氨溶液中各離子濃度的大小關系____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y可以形成化合物XY2,下列有關敘述不正確的是( )
A. 若XY2是共價化合物,則X與Y的原子序數可能相差1
B. 若XY2是離子化合物,則X與Y的原子序數可能相差8
C. 若X與Y的原子序數相差5,則離子化合物XY2中X的離子半徑比Y離子半徑小
D. 若X與Y的原子序數相差6,則共價化合物XY2可溶于強堿溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】幾種晶體的晶胞如圖所示;所示晶胞從左到右分別表示的物質是
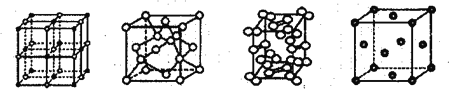
A. 碘、銅、氯化鈉、金剛石 B. 氯化鈉、金剛石、碘、銅
C. 氯化鈉、銅、碘、金剛石 D. 銅、氯化鈉碘、金剛石
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應①Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常數為K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常數為K;
溫度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若500℃時進行反應①,CO2的起始濃度為2 mol·L-1,CO的平衡濃度為____。
(2)上述反應中的a_______0(填“大于”“小于”或“等于”)。
(3)700℃時反應①達到平衡狀態(tài),要使該平衡向右移動,其他條件不變時,可以采取的措施有____(填序號)。
A.縮小反應器體積 B.通入CO2 C.溫度升高到900℃ D.使用合適的催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學用語表示不正確的是
A. 氫離子結構示意圖:![]() B. 中子數為20 的Ar原子:
B. 中子數為20 的Ar原子:![]()
C. 二氧化硅的結構式:O=Si=O D. 乙烯的結構簡式:CH2=CH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2 L密閉容器內,800 ℃時NO(g)和O2(g)反應生成NO2(g)的體系中,n(NO)隨時間的變化如下表所示:
時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反應________(填“是”或“不是”)可逆反應,在第5 s時,NO的轉化率為________。
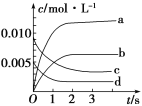
(2)如圖,表示NO2變化曲線的是____,用O2表示從0~2 s內該反應的平均速率v=________。
(3)能使該反應的反應速率增大的是________。
a.及時分離出NO2氣體
b.適當升高溫度
c.增大O2的濃度
d.選擇高效的催化劑
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com