
【題目】(1)過渡金屬元素鐵能形成多種配合物,如:[Fe(H2NCONH2)6](NO3)3。[三硝酸六尿素合鐵(Ⅲ)]和Fe(CO)x等。
①基態Fe3+的M層電子排布式是________________。
②尿素(H2NCONH2)分子中C、N原子的雜化方式分別是__________、__________。
③配合物Fe(CO)x的中心原子價電子數與配體提供電子數之和為18,則x =_______。
(2)Zn2+能與NH3形成配離子[Zn(NH3)4]2+。配位體NH3的VSEPR模型名稱為_____;在[Zn(NH3)4]2+中,Zn2+位于正四面體中心,N位于正四面體的頂點,試在左下圖中表示出[Zn(NH3)4]2+中Zn2+與N之間的化學鍵_____。

【答案】 3s23p63d5 sp2 sp3 5 四面體 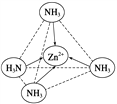
【解析】(1)①Fe原子核外有26個電子,核外電子排布為1s22s22p63s23p63d64s2,Fe原子失去4s能級2個電子、3d能級1個電子形成Fe3+,Fe3+電子排布式為1s22s22p63s23p63d5,基態Fe3+的M層電子排布式為3s23p63d5 ; ②由尿素分子的結構式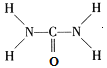 可知,尿素分子中C原子成2個C-N鍵、1個C=O鍵,沒有孤對電子,雜化軌道數目為3,C原子采取sp2雜化,N原子成3個單鍵,含有1對孤對電子,雜化軌道數為4,N原子采取sp3雜化;③ 配合物Fe(CO)x的中心原子是鐵原子,其價電子數是8,每個配體提供的電子數是2,8+2x=18,x=5;(2)Zn2+能與NH3形成配離子[Zn(NH3)4]2+。根據價層電子對互斥理論,配位體NH3價層電子對個數=3+
可知,尿素分子中C原子成2個C-N鍵、1個C=O鍵,沒有孤對電子,雜化軌道數目為3,C原子采取sp2雜化,N原子成3個單鍵,含有1對孤對電子,雜化軌道數為4,N原子采取sp3雜化;③ 配合物Fe(CO)x的中心原子是鐵原子,其價電子數是8,每個配體提供的電子數是2,8+2x=18,x=5;(2)Zn2+能與NH3形成配離子[Zn(NH3)4]2+。根據價層電子對互斥理論,配位體NH3價層電子對個數=3+![]() (5-3×1)=4,所以其VSEPR模型名稱為正四面體;在[Zn(NH3)4]2+中,Zn2+位于正四面體中心,N位于正四面體的頂點,表示[Zn(NH3)4]2+中Zn2+與N之間的化學鍵如圖:
(5-3×1)=4,所以其VSEPR模型名稱為正四面體;在[Zn(NH3)4]2+中,Zn2+位于正四面體中心,N位于正四面體的頂點,表示[Zn(NH3)4]2+中Zn2+與N之間的化學鍵如圖: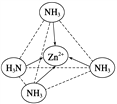 。
。


 七星圖書口算速算天天練系列答案
七星圖書口算速算天天練系列答案 初中學業考試導與練系列答案
初中學業考試導與練系列答案科目:高中化學 來源: 題型:
【題目】下列對于“摩爾”的說法和理解正確的是( )
A. 摩爾是國際科學界建議采用的一種物理量
B. 摩爾可以把物質的宏觀數量與微觀粒子的數量聯系起來
C. 國際上規定,0.012 kg碳原子所含有的碳原子數目為1 mol
D. 摩爾是物質的量的單位,簡稱摩,符號為mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烯和乙烷的混合氣體共a mol,與b mol O2共存于一密閉容器中,點燃后充分反應,乙烯和乙烷全部消耗完,得到CO和CO2的混合氣體和45 g H2O,試求:
(1)當a=1時,乙烯和乙烷的物質的量之比n(C2H4)∶n(C2H6)= 。
(2)當a=1,且反應后CO和CO2的混合氣體的物質的量為反應前O2的![]() 時,b= ,得到的CO和CO2的物質的量之比n(CO)∶n(CO2)= 。
時,b= ,得到的CO和CO2的物質的量之比n(CO)∶n(CO2)= 。
(3)a的取值范圍是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室常用鹽酸的質量分數為36.5%,密度為1.20g/cm3。
(1)此濃鹽酸的物質的量濃度是多少?(列式計算)_________________
(2)配制100mL3.00mol/L的鹽酸,需以上濃鹽酸多少mL?(列式計算)_____________
(3)用濃鹽酸配制該稀鹽酸需要以下哪些步驟(按操作順序填寫序號)_________________
①計算②裝瓶③用50mL量筒量取一定體積的濃鹽酸④洗滌⑤移液⑥稀釋⑦定容⑧搖勻
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下反應N2O4(g)![]() 2NO2(g)(正反應為吸熱反應),在密閉容器中達到平衡,下列說法正確的是
2NO2(g)(正反應為吸熱反應),在密閉容器中達到平衡,下列說法正確的是
①加壓時(體積變小),將使正反應速率增大②保持體積不變,加入少許NO2,將使正反應速率減小;③保持體積不變,加入少許N2O4,再達到平衡時顏色變深;④保持體積不變,升高溫度,再達平衡時顏色變深 ⑤升高溫度,正反應速率減小,平衡逆向移動
A. ①④⑤ B. ③④⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個不導熱的密閉反應器中,只發生兩個反應:
a(g)+ b(g)![]() 2c(g)△H1<0
2c(g)△H1<0
x(g)+ 3y(g)![]() 2z(g)△H2 >0
2z(g)△H2 >0
進行相關操作且達到平衡后(忽略體積改變所做的功),下列敘述錯誤的是
A.等壓時,通入惰性氣體,c的物質的量不變
B.等壓時,通入z氣體,反應器中溫度升高
C.等容時,通入惰性氣體,各反應速率不變
D.等容時,通入z氣體,y的物質的量濃度增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、X、Y、Z是周期表前36號元素中的四種常見元素,其原子序數依次增大。W、Y的氧化物是導致酸雨的主要物質,X的基態原子核外有7個原子軌道填充了電子,Z能形成紅色(或磚紅色)的Z2O和黑色的ZO兩種氧化物。
(1)W位于元素周期表第________周期第________族。W的氣態氫化物穩定性比H2O(g)________(填“強”或“弱”)。
(2)Y的基態原子價層電子排布式為________________,Y的第一電離能比X的________(填“大”或“小”)。
(3)Y的最高價氧化物對應水化物的濃溶液與Z的單質反應的化學方程式是
________________________________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com