
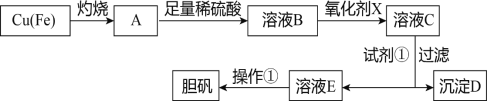
【題目】下圖是利用廢銅屑(含雜質鐵)制備膽礬(硫酸銅晶體)的流程。
部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
開始沉淀 | 2.7 | 7.5 | 4.4 |
完全沉淀 | 3.7 | 9.7 | 6.7 |
請回答:
(1)溶液B中含有的陽離子有____________________(填離子符號)。
(2)下列物質中最適宜做氧化劑X的是__________(填字母)。
a.NaClO b.H2O2 c.KMnO4
(3)加入試劑①是為了調節pH,要調整pH范圍是_____________,則試劑①可以選擇______________(填化學式)。
(4)沉淀D加入鹽酸和鐵粉,可以制得FeCl2溶液,實驗室保存FeCl2溶液,需加入過量的鐵粉,其原因是____________________________________(用離子方程式表示)。
(5)溶液E經過操作①可得到膽礬,操作①為________________________、過濾、洗滌。
(6)已知溶液中c(Cu2+)與pH的關系為lgc(Cu2+)=8.6-2pH,若溶液中c(Cu2+)為1mol/L,此時溶液中的Fe3+能否沉淀完全:___________(填“能”或“否”) 。
【答案】Cu2+、Fe2+、Fe3+、H+ b 3.7 ~4.4 CuO【或Cu(OH)2或CuCO3】 Fe+2Fe3+=3Fe2+ 蒸發濃縮、冷卻結晶 能
【解析】
灼燒廢銅屑,Cu反應生成CuO、Fe被氧化生成Fe3O4,A的成分為CuO、Fe3O4,A與足量稀硫酸反應生成CuSO4、FeSO4、Fe2(SO4)3,B中含有CuSO4、FeSO4、Fe2(SO4)3和稀硫酸,加入氧化劑X得到溶液C,X能氧化亞鐵離子生成鐵離子但是不能引進新的雜質,則X為H2O2,加入試劑①是為了調節pH,加入的物質能和氫離子反應但是不能引進新的雜質,過濾得到的沉淀D為Fe(OH)3,溶液E為CuSO4,從溶液中蒸發濃縮、冷卻結晶、過濾得到膽礬,據此解答。
(1)A中含有CuO、Fe3O4,A和稀硫酸反應且稀硫酸過量導致溶液B中含有CuSO4、FeSO4、Fe2(SO4)3和稀硫酸,所以B中含有陽離子為Cu2+、Fe2+、Fe3+、H+;
(2)氧化劑X能氧化亞鐵離子生成鐵離子且不能引進新的雜質,雙氧水被還原為水,不引進新的雜質,但是次氯酸鈉和高錳酸鉀溶液能引進新的雜質,所以選雙氧水,故答案為b;
(3)加入試劑①是為了調節pH,試劑①能和氫離子反應且不能引進新的雜質,該試劑為CuO或Cu(OH)2或CuCO3,由于是沉淀鐵離子,而不沉淀銅離子,所以根據表中數據可知要調整pH范圍是3.7~4.4;
(4)亞鐵離子不穩定,易被空氣氧化生成鐵離子,因此實驗室保存FeCl2溶液,需加入過量的鐵粉,反應的離子方程式為Fe+2Fe3+=3Fe2+;
(5)溶液E為硫酸銅,硫酸銅溶液經過操作①可得到膽礬,由于硫酸銅易溶于水,則操作①為蒸發濃縮、冷卻結晶、過濾洗滌;
(6)已知溶液中c(Cu2+)與pH的關系為lgc(Cu2+)=8.6-2pH,若溶液中c(Cu2+)為1mol/L,則此時溶液的pH=(8.6-lg1)÷2=4.3>3.7,所以溶液中的Fe3+能沉淀完全。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】以Pt-g-C3N4為催化劑,用光催化氧化法脫除NO的過程如圖所示。
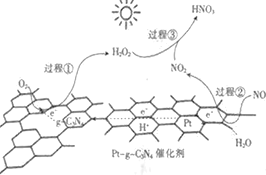
該脫除過程中,下列說法不正確的是
A. 該過程為太陽能轉化為化學能
B. Pt端發生的是氧化反應
C. 過程①發生的電極反應為H2O2-2e-=O2↑+2H+
D. 過生③的化學方程式為2NO2+H2O2=2HNO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于離子共存或化學用語的表述正確的是
A. 由水電離出的c(H+)=1.0×10-12 molL1的溶液中可能大量存在:Na+、K+、SO32-、HCO3-
B. 常溫下,c(OH-)/c(H+)=1.0×1012的溶液中可能大量存在NH4+、Na+、Cl-、NO3-
C. 硫酸氫鈉溶于水的電離方程式為:NaHSO4=Na++H++SO42-
D. 碳酸鈉溶液呈堿性的原因:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為電解飽和食鹽水裝置,下列有關說法不正確的是

A. 左側電極上發生氧化反應
B. 右側生成的氣體能使濕潤的淀粉碘化鉀試紙變藍
C. 電解一段時間后,B口排出NaOH溶液
D. 電解飽和食鹽水的離子方程式: 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)利用I2O5可使CO與H2O(g)反應轉化為CO2和H2,從而有效減少大氣污染。該過程可通過圖1所示的兩步反應循環實現。
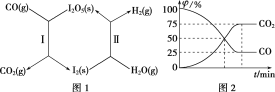
其中:反應Ⅰ為I2O5(s)+5CO(g)=I2(s)+5CO2(g) ΔH=a kJ·mol-1
反應Ⅱ中,生成1 mol H2(g)時,反應熱ΔH=b kJ·mol-1。
①總反應的熱化學方程式為(反應熱ΔH用含a、b的代數式表示)______。
②在恒溫密閉容器中加入一定量的CO(g)和I2O5(s),發生反應Ⅰ并達到平衡。測得體系中各氣體組分的體積分數φ隨時間t的變化如圖2所示。則此反應用氣體分壓表示的平衡常數Kp=______(已知:氣體分壓=氣體總壓×體積分數)。
(2)已知鉛鹽中,Pb(NO3)2、(CH3COO)2Pb易溶于水,PbSO4、PbS難溶于水,室溫下其溶度積常數為Ksp(PbSO4)=1.06×10-8;Ksp(PbS)=3.40×10-28。
①將一定量的PbSO4加入足量飽和CH3COONH4溶液中,微熱,并不斷攪拌,因發生復分解反應,PbSO4緩慢溶解。能發生此復分解反應的原因是______。
②某溶液中主要含有S2-、SO42-等陰離子,向其中滴加Pb(NO3)2溶液,當PbSO4開始析出時,溶液中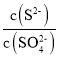 =________。
=________。
(3)鈦基二氧化鉛(Ti/PbO2)是重要的電極材料,工業上用電解法制作,主要流程如圖:
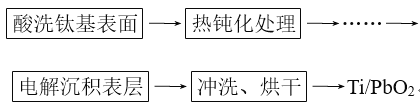
其中“電解沉積表層”是制作的關鍵,方法是電解可溶性鉛鹽溶液,使生成的PbO2沉積在陽極金屬鈦(Ti)上。主反應為2Pb2++2H2O=Pb+PbO2+4H+。
①必須預先將陽極金屬鈦進行“熱鈍化處理”,原因是_______。
②電解槽中,陽極主要的反應式為___;該法的缺點是陽極、陰極均會發生副反應。其中陰極上產生的氣體副產物是____。
③電解法制得的PbO2晶體中含有少量的+2價鉛,從而導致氧原子所在位置出現少量“空穴”(即化學式為PbOx,但x<2)。若電解時每生成1molPbOx轉移1.94NA個e-(NA為阿伏加德羅常數的值),則鉛元素中+2價鉛所占的質量分數為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式,書寫正確的是( )
A.鹽酸與石灰石反應:CO32ˉ+2H+ = CO2↑+H2O
B.鐵與稀鹽酸反應:2Fe+6H+ = 2Fe3++3H2↑
C.氫氧化鐵膠體的制備:FeCl3 + 3H2O = Fe(OH)3+3HCl
D.硫酸銅溶液中滴加氫氧化鋇溶液:Ba2++2OH-+Cu2++SO42ˉ = BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化學 來源: 題型:
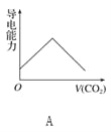
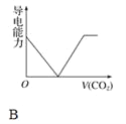
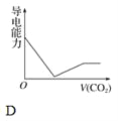
【題目】離子的摩爾電導率可用來衡量電解質溶液中離子導電能力的強弱,摩爾電導率越大,離子在溶液中的導電能力越強。已知Ca2+、OH-、HCO3—的摩爾電導率分別為0.60、1.98、0.45,據此可判斷,向飽和的澄清石灰水中通入過量的二氧化碳,溶液導電能力隨二氧化碳通入量的變化趨勢正確的是( )

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有五種可溶性物質A、B、C、D、E,它們所含的陰、陽離子互不相同,分別含有五種陽離子Al3+、Fe3+、Cu2+、Ba2+、K+和五種陰離子NO![]() 、OH-、Cl-、CO
、OH-、Cl-、CO![]() 、Xn-(n=1或2)中的一種。
、Xn-(n=1或2)中的一種。
(1)某同學通過比較分析,認為無須檢驗就可判斷其中必有的兩種物質是_____和_____。
(2)物質C中含有離子Xn-。為了確定Xn-,現將(1)中的兩種物質記為A和B,當C與A的溶液混合時產生藍色沉淀,向該沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固體,則X為________(填字母)。
A.Br- B.CH3COO- C.SO![]() D.HCO
D.HCO![]()
(3)將38.4 g Cu投入裝有足量D溶液的試管中,Cu不溶解,再滴加稀H2SO4,Cu逐漸溶解,管口附近有紅棕色氣體出現,則物質D一定含有上述離子中的________(填相應的離子符號),寫出Cu溶解的離子方程式____________________________________________,若要將Cu完全溶解,至少加入H2SO4的物質的量是_____________。
(4)E溶液與氫碘酸反應時可生成使淀粉變藍的物質,該反應的離子方程式為___________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com