
【題目】SO2與我們的生活息息相關,低濃度SO2廢氣的處理是工業難題,目前常用的一種處理方法如下
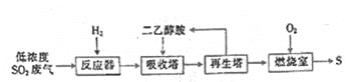
已知:反應器中發生反應3H2+SO2=H2S+2H2O。
下列有關說法不正確的是( )
A.SO2是有毒氣體,能形成酸雨破壞環境,不能用作食品的防腐劑
B.二乙醇胺的作用是吸收H2S,且可以循環使用
C.再生塔中加熱分解重新獲得H2S,主要目的是富集H2S
D.理論上燃燒室中的O2可以用SO2代替
 暑假作業海燕出版社系列答案
暑假作業海燕出版社系列答案 本土教輔贏在暑假高效假期總復習云南科技出版社系列答案
本土教輔贏在暑假高效假期總復習云南科技出版社系列答案科目:高中化學 來源: 題型:
【題目】A、B、C三種短周期元素,它們的原子序數依次增大。A元素原子的核外p電子數比s電子數少1,B元素原子核外有4種能級,且全部充滿電子;C元素的主族序數與周期數的差為4。
(1)A的基態原子中能量最高的電子,其電子云在空間有________個方向,原子軌道呈________形。
(2)某同學推斷B基態原子的核外電子排布為![]() ,該同學所畫的電子排布圖違背了_____________。
,該同學所畫的電子排布圖違背了_____________。
(3)C位于______族_____區,價電子排布式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是部分短周期元素的單質及其化合物(或其溶液)的轉化關系。已知在常溫常壓下,A是固體,B、C、D、E是非金屬單質且都是氣體,C呈黃綠色;化合物F是淡黃色固體,化合物G的焰色反應為黃色,化合物Ⅰ和J通常狀況下呈氣態;D和E反應生成一種刺激性氣味的氣體。
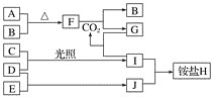
請回答下列問題:
(1)E和J的化學式分別是________和________。
(2)寫出F和CO2反應的化學方程式并用單線橋法表示電子轉移的情況:_________。
(3)將少量單質C通入盛有淀粉碘化鉀溶液的試管中,溶液變藍色,該反應的離子方程式為_________。
(4)標況下3.36 L氣體B與A完全反應,轉移電子的數目為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() ,該有機物能發生( )
,該有機物能發生( )
①取代反應,②加成反應,③消去反應,④使溴水褪色,⑤使酸性KMnO4溶液褪色,⑥與AgNO3溶液生成白色沉淀,⑦聚合反應
A.以上反應均可發生B.只有⑦不能發生
C.只有⑥不能發生D.只有②不能發生
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗結果不能作為相應定律或原理的證據之一的是( )
(阿伏加德羅定律:在同溫同壓下,相同體積的任何氣體含有相同數目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 蓋斯定律 | 阿伏伽德羅定律 | |
實驗方案 |
|
|
|
|
結果 | 左球氣體顏色加深 右球氣體顏色變淺 | 燒瓶中冒氣泡 試管中出現渾濁 | 測得 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示晶體結構是一種具有優良的電壓、電光等功能的晶體材料的最小結構單元(晶胞).晶體內與每個“Ti”緊鄰的氧原子數和這種晶體材料的化學式分別是(各元素所帶電荷均已略去)( )
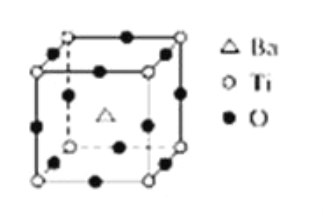
A. 8;BaTi8O12
B. 8;BaTi4O9
C. 6;BaTiO3
D. 3;BaTi2O3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列框圖涉及的物質所含元素中,除一種元素外,其余均為1~18號元素。

已知:A、F為無色氣體單質,B為具有刺激性氣味的氣體,化學家哈伯因合成B獲得1918年的諾貝爾化學獎。C為黑色氧化物,E為紫紅色金屬單質,I為藍色沉淀(部分反應的產物未列出)。請回答下列問題:
(1)常溫下鋁遇到G的濃溶液后表面形成一層致密的保護膜,該現象稱為___________。
(2)E與G的稀溶液反應的離子方程式為_________。
(3)在25 ℃和101 kPa的條件下,將VL的B氣體溶于100 mL水中,得到密度為ρg·mL-1的溶液M,則M溶液的物質的量濃度為________ mol·L-1。(已知25 ℃、101 kPa條件下氣體摩爾體積為24.5 L·mol-1,不必化簡)
(4)分別蘸取B的濃溶液和G的濃溶液的玻璃棒,接近后的現象是_________。
(5)B和C反應的化學方程式為__________。
(6)J、K是同種金屬的不同氯化物,K為白色沉淀。寫出SO2還原J生成K的離子方程式:______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗中,所使用的裝置(部分夾持裝置略)、試劑和操作方法都正確的是 ( )
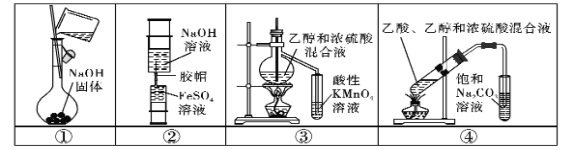
A.用裝置①配制250 mL0.1 mol.L-1的NaOH溶液
B.用裝置②制備少量Fe(OH)2固體
C.用裝置③驗證乙烯的生成
D.用裝置④制取少量乙酸乙酯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅是人類最早發現并廣泛使用的一種金屬。向硫酸銅溶液中逐滴滴加稀氨水,產生藍色沉淀:繼續滴加稀氨水,沉淀溶解,溶液最終變為深藍色:再向深藍色溶液中加入無水乙醇,析出[Cu(NH3)4]SO4·H2O。回答下列問題:
(1)基態Cu原子中,電子在核外排布的原子軌道共有________個。
(2)N、O、S元素的原子對鍵合電子吸引力最大的是_________。
(3)乙醇分子中C原子的雜化方式是_________
(4)[Cu(NH3)4]2+中,提供孤對電子的是________,Cu(NH3)2Cl2有兩種同分異構體,其中一種可溶于水,則此種化合物是_______(填“極性”或“非極性”)分子,由此推知[Cu(NH3)4]2+的空間構型是_________。
(5)硫元素對應的含氧酸酸性是H2SO4
強于H2SO3,其原因為___________________。
(6)銅的一種氧化物晶體結構如圖所示,
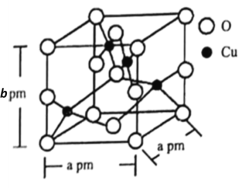
該氧化物的化學式是________。若該晶體結構為長方體,其參數如圖,阿伏加德羅常數為NA,則該氧化物的密度為_______g·cm-3。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com