
【題目】(1)鐵炭混合物在水溶液中可形成許多微電池。將含有Cr2O72-的酸性廢水通過鐵炭混合物,在微電池正極上Cr2O72-轉化為Cr3+,其電極反應式為______________________________________。
(2)氫能是發展中的新能源,它的利用包括氫的制備、儲存和應用三個環節。與汽油相比,氫氣作為燃料的優點是_____________(至少答出兩點)。但是氫氣直接燃燒的能量轉換率遠低于燃料電池,寫出堿性氫氧燃料電池的負極反應式:__________________________________。
(3)FeSO4在一定條件下可制得FeS2(二硫化亞鐵)納米材料。該材料可用于制造高容量鋰電池,電池放電時的總反應為4Li+FeS2===Fe+2Li2S,正極反應式是_____________________________。
(4)右圖所示原電池正極的反應式為___________________________。
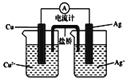
【答案】 Cr2O72-+14H++6e-==2Cr3++7H2O 污染小,可再生,來源廣,資源豐富,燃燒熱值高 H2+2OH--2e-===2H2O FeS2+4Li++4e-===Fe+2Li2S(或FeS2+4e-===Fe+2S2-) Ag++e-===Ag
【解析】(1)鐵炭混合物在水溶液中可形成許多微電池。將含有Cr2O72-的酸性廢水通過鐵炭混合物,在微電池正極上Cr2O72-獲得電子,被還原產生Cr3+,則正極上發生的電極反應式為Cr2O72-+6e-+14H+=2Cr3++7H2O;(2)與汽油相比,氫氣作為燃料的優點有污染小;可再生;來源廣;資源豐富;燃燒熱值高等,堿性氫氧燃料電池的負極反應式為H2+2OH--2e-=2H2O;(3)電池放電時的總反應為4Li+FeS2=Fe+2Li2S,正極發生還原反應,所以是二硫化亞鐵得到電子生成鐵和硫離子,電極反應式為:FeS2+4e-=Fe+2S2-。(4)銅的金屬性強于銀,銅是負極,銀是正極,正極的反應式為Ag++e-=Ag。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是
A. 一定條件下反應2SO2+O2![]() 2SO3達到平衡時,v(O2)正=2v(SO3)逆
2SO3達到平衡時,v(O2)正=2v(SO3)逆
B. 用如圖所示方法可保護鋼閘門不被腐蝕

C. 常溫下,向NH4Cl溶液中加入少量NaOH固體,溶液中![]() 的值增大
的值增大
D. 常溫下, pH=2的HCl溶液與pH=12的Ba(OH)2溶液等體積混合,兩者恰好完全反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物G是一種治療帕金森癥的藥品,其合成路線流程圖如下:
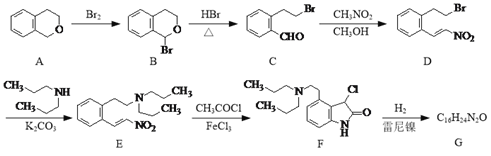
(1)D中的官能團名稱為溴原子、______和______。
(2)B、C、D三種有機物與NaOH乙醇溶液共熱,能發生消去反應的是____(填字母)。
(3)寫出同時滿足下列條件的D的一種同分異構體的結構簡式:______。
①分子中只有3種不同化學環境的氫;
②能發生銀鏡反應,苯環上的一取代物只有一種。
(4)F通過取代反應得到G,G的分子式為C16H24N2O,寫出G的結構簡式:______。
(5)已知:![]() (R代表烴基或H)。
(R代表烴基或H)。
請寫出以![]() 和CH3NO2為原料制備
和CH3NO2為原料制備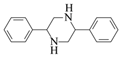 的合成路線流程圖(無機試劑和有機溶劑任用,合成路線流程圖示例見本題題干)。__________________
的合成路線流程圖(無機試劑和有機溶劑任用,合成路線流程圖示例見本題題干)。__________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】當反應物的總能量高于生成物時,該反應為______________反應;當反應物的總能量低于生成物時,該反應為______________反應(填“吸熱或放熱”),能量越高的物質越______________(填“穩定或不穩定”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子檢驗的方法正確的是
A. 某溶液![]() 有白色沉淀,說明原溶液中有Cl-
有白色沉淀,說明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,說明原溶液中有SO42-
有白色沉淀,說明原溶液中有SO42-
C. 某溶液![]() 有藍色沉淀,說明原溶液中有Cu2+
有藍色沉淀,說明原溶液中有Cu2+
D. 某溶液![]() 生成無色氣體,說明原溶液中有CO32-
生成無色氣體,說明原溶液中有CO32-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2L的密閉容器中,發生以下反應:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是3mol,在前10sA的化學反應速率為0.12mol·L-1·s-1,則10s時,容器中B的物質的量是
2C(g)+D(g)。若最初加入的A和B都是3mol,在前10sA的化學反應速率為0.12mol·L-1·s-1,則10s時,容器中B的物質的量是
A. 0.6mol B. 1.2mol C. 1.8mol D. 2.4mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課題組以硫鐵礦燒渣(含 Fe2O3、 Fe3O4、 Al2O3、 CaO、 SiO2 等)為原料制取軟磁用 Fe2O3(要求純度>99.2%, CaO 含量<0.01%)。其工藝流程如下(所加入試劑均稍過量):
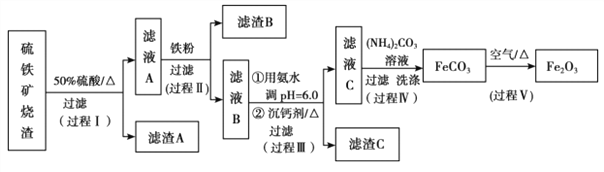
已知:生成氫氧化物的 pH 如下表所示
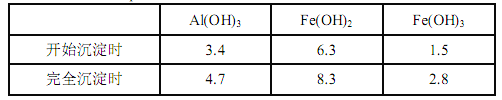
(1)濾渣 A 的主要成分是__________。
(2)在過程Ⅱ中可觀察到產生少量氣泡,溶液顏色慢慢變淺。能解釋該實驗現象的離子方程式有__________。
(3)在過程Ⅱ中,課題組對濾液 A 稀釋不同倍數后,加入等質量的過量鐵粉,得出 Fe3+濃度、還原率和反應時間的關系如圖所示:結合上述實驗結果說明:課題組選擇稀釋后c(Fe3+)為 1.60mol/L 左右的理由是______。
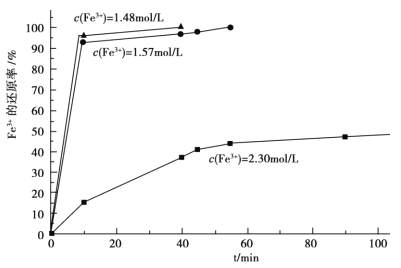
(4)在過程Ⅲ中,課題組在相同條件下,先選用了不同沉鈣劑進行實驗,實驗數據見下表:(已知:濾液 B 中鈣的含量以 CaO 計為 290—310mg/L)
沉鈣劑 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根據實驗結果, 選擇適宜的沉鈣劑,得到濾渣 C 的主要成分有__________。
(5)在過程Ⅳ中,反應溫度需要控制在 35℃以下,不宜過高,其可能的原因是__________。
(6)在過程Ⅴ中,反應的化學方程式是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有一定量含有Na2O雜質的Na2O2試樣,用下圖的實驗裝置測定Na2O2試樣的純度。(可供選用的反應物只有CaCO3固體、6 mol·L1硫酸、6 mol·L1鹽酸和蒸餾水)

回答下列問題:
(1)裝置A中發生反應的化學方程式是______________________________________。
(2)裝置B的作用是______________,裝置C的作用是______________,裝置E的作用是_____________。
(3)裝置D中發生反應的化學方程式是______________________________________。
(4)若開始時測得樣品的質量為2.0 g,反應結束后測得氣體體積為224 mL(標準狀況),則Na2O2試樣的純度為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com