
正丁醚常用作有機反應的溶劑。實驗室制備正丁醚的反應和主要實驗裝置如下:
2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
反應物和產物的相關數據如下
| | 相對分子質量 | 沸點/℃ | 密度/(g/cm3) | 水中溶解性 |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 幾乎不溶 |
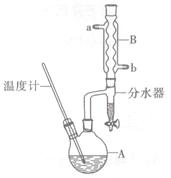
(1)先加入正丁醇,再加入濃硫酸。
(2)b
(3)濃硫酸;上
(4)洗去有機層中殘留的NaOH及中和反應生成的鹽。
(5)D
(6)正丁醇;水
(7)34%
解析試題分析:(1)步驟①中濃硫酸和正丁醇的添加順序為先向其中加入密度小的正丁醇,然后再加入密度大的濃硫酸。類似濃硫酸的稀釋。(2)水冷凝器的冷卻水加入方式是下口進入冷水,熱水從上口流出。選項為b.(3)在反應混合物中,濃硫酸能溶解于水中,正丁醚不溶,正丁醇微溶于水。所以步驟③的目的是初步洗去濃硫酸。由于正丁醚、正丁醇密度都比水小,所以粗產物應從分液漏斗的上口分離出來。(4)步驟③中最后一次水洗的目的為洗去有機層中殘留的NaOH及中和反應生成的鹽。(5)本實驗的目的是為了制取正丁醚,而正丁醚的沸點為142℃.所以步驟⑤中,加熱蒸餾時應收集142℃時的餾分。選項為d。(6)液體混合物加熱會蒸出,經過冷凝器降溫會轉化為液體,由于正丁醇的密度不水小。又微溶于水,所以在上層,水在下層。因此分水器中上層液體的主要成分為正丁醇;下層液體的主要成分為水。(7)n(正丁醇)=37g÷74g/mol=0.5mol .根據方程式中正丁醇與正丁醚的相互關系可知:正丁醚的理論產物質的量為n(正丁醚)= 0.25mol. m(正丁醚)= 0.25mol×130g/mol=32.5g實際產的正丁醚的物質的量為:m(正丁醚)=" 11" g。所以本實驗中,正丁醚的產率為(11g÷32.5g)×100%=34%。
考點:考查化學實驗基本操作、混合物的分離方法、物質的產率的計算的知識。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:實驗題
(12分)高純硝酸鍶[化學式:Sr(NO3)2]用于制造信號燈、光學玻璃等。
⑴工業級硝酸鍶中常含有硝酸鈣、硝酸鋇等雜質,其中硝酸鈣可溶于濃硝酸,而硝酸鍶、硝酸鋇不溶于濃硝酸。請結合相關信息,補充完整提純硝酸鍶的下列實驗步驟:
①取含雜質的硝酸鍶樣品, ,攪拌。
② 。
③將濾渣溶于水中,加略過量鉻酸使Ba2+沉淀,靜置后加入肼(N2H4)將過量鉻酸還原,調節pH=7~8,過濾。
④將濾液用硝酸調節pH=2~3, ,過濾,洗滌。
⑤將得到的Sr(NO3)2·2H2O晶體在100 ℃條件下干燥,得到高純硝酸鍶。
⑵Sr(NO3)2受熱易分解,生成Sr(NO2)2和O2;在500 ℃時Sr(NO2)2進一步分解生成SrO及氮氧化物。取一定質量含Sr(NO2)2的Sr(NO3)2樣品,加熱至完全分解,得到5.20 g SrO固體和5.08 g混合氣體。計算該樣品中Sr(NO3)2的質量分數(寫出計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
實驗室制取乙酸丁酯的實驗裝置有如下圖所示兩種裝置供選用。其有關物質的物理性質如下表: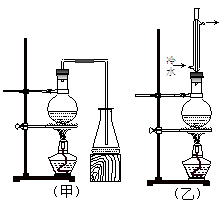
| | 乙酸 | 1-丁醇 | 乙酸丁酯 |
| 熔點(℃) | 16.6 | -89.5 | -73.5 |
| 沸點(℃) | 117.9 | 117 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
已知某酸性土壤浸取液中除Fe3+外,還含有一定量Mg2+和Al3+。請設計合理實驗檢驗該浸取液中的Mg2+、Al3+。
限選實驗用品與試劑;燒杯、試管、玻璃棒、滴管、玻璃片、pH試紙;浸取液、20%KSCN、0.1 mol·L-1 NaOH、6 mol·L-1 NaOH、0.1 mol·L-1 HCl、蒸餾水。
必要時可參考:
| 沉淀物 | 開始沉淀時的pH | 沉淀完全時的pH |
| Mg(OH)2 | 9.6 | 11.1 |
| Fe(OH)3 | 2.7 | 3.7 |
| 實驗操作 | 預期現象和結論 |
| 步驟1: | |
| 步驟2: | |
| 步驟3: | |
| …… | |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
實驗室可用MnO2和KClO3混合加熱的方法制取氧氣:2KClO3 2KCl+3O2↑
2KCl+3O2↑
I.現有下列儀器或裝置:
(1)A-D裝置中,用作KClO3為原料制氧氣的反應裝置是____(填序號)。
(2)排水法收集氧氣,接口順序是:氧氣出口→___→___→g→h→燒杯(填序號)。
Ⅱ.KClO3分解時尚有副反應,導致收集到的氣體有異味。據推測,副產物可能是O3、Cl2、ClO2中的一種或幾種。資料表明:O3、Cl2、ClO2的沸點依次為-111℃、-34℃和11℃,且O3、ClO2也能將KI氧化為I2。為探究副反應氣體產物的成分,將KClO3分解產生的氣體經干燥后通入如右裝置進行實驗:
(3)若要確認副產物中含Cl2,F中應盛放_____溶液。
(4)確定副產物中含有ClO2的現象是_________________。
(5)實驗時若D中無現象,E中試紙變藍,能否得出副產物含有臭氧的結論?
答:_____ (填“能”或“不能”)。理由是________________________________。
Ⅲ.ClO2是飲用水消毒劑。用ClO2處理過的飲用水(pH為5.5~6.5)除含有ClO2外,常含有一定量對人體不利的ClO2-。為測定此飲用水中兩者成分,進行如下實驗:準確量取v mL水樣加入到錐形瓶中,調節水樣pH=8,加人足量KI晶體,發生如下反應:2ClO2+2I- =I2+2ClO2-,反應結束后產生amolI2;繼續調節溶液pH=1,又發生如下反應:ClO2-+4H++4I- =2I2+Cl-+2H2O,反應結束后叉產生bmolI2。
(6)飲用水中c(ClO2-)=_____________mol·L- 1(用含字母的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
K3[Fe(C2O4)3]·3H2O [三草酸合鐵(Ⅲ)酸鉀晶體]易溶于水,難溶于乙醇,可作為有機反應的催化劑。實驗室可用廢鐵屑等物質為原料制備,并測定產品的純度。相關反應的化學方程式為:Fe + H2SO4 =FeSO4 + H2↑ FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
回答下列問題:
(1)使用廢鐵屑前,往往將其在1.0mol.L-1Na2CO3溶液中浸泡數分鐘,其目的是 。然后使用 (填寫操作名稱)分離并洗滌鐵屑。
(2)析出的K3[Fe(C2O4)3]·3H2O晶體可通過如下圖所示裝置通過減壓過濾與母液分離。下列關于減壓過濾的操作正確的是 。
| A.選擇比布氏漏斗內徑略小又能將全部小孔蓋住的濾紙 |
| B.放入濾紙后,直接用傾析法轉移溶液和沉淀,再打開水龍頭抽濾 |
| C.洗滌晶體時,先關閉水龍頭,用蒸餾水緩慢淋洗,再打開水龍頭抽濾 |
| D.抽濾完畢時,應先斷開抽氣泵和吸濾瓶之間的橡皮管,以防倒吸 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
環己酮是一種重要的有機化工原料。實驗室合成環己酮的反應如下: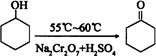
環己醇和環己酮的部分物理性質見下表:
| 物質 | 相對分子質量 | 沸點(℃) | 密度(g·cm—3、20 ℃) | 溶解性 | |
| 環己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 | |
| 環己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 | |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某研究小組用如圖裝置進行SO2與FeCl3溶液反應的相關實驗(夾持裝置已略去)。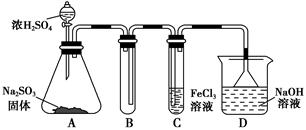
(1)在配制氯化鐵溶液時,需先把氯化鐵晶體溶解在________中,再加水稀釋,這樣操作的目的是________,操作中不需要的儀器有________(填入正確選項前的字母)。
a.藥匙 b.燒杯 c.石棉網 d.玻璃棒 e.坩堝
(2)通入足量SO2時,C中觀察到的現象為______________________________。
(3)根據以上現象,該小組同學認為SO2與FeCl3溶液發生了氧化還原反應。
①寫出SO2與FeCl3溶液反應的離子方程式:___________________________;
②請設計實驗方案檢驗有Fe2+生成:__________________________________;
③該小組同學向C試管反應后的溶液中加入硝酸酸化的BaCl2溶液,若出現白色沉淀,即可證明反應生成了SO42-。該做法________(填“合理”或“不合理”),理由是_______________________________________________________________。
(4)D裝置中倒置漏斗的作用是______________________________________。
(5)為了驗證SO2具有還原性,實驗中可以代替FeCl3的試劑有________(填入正確選項前的字母)。
a.濃H2SO4 b.酸性KMnO4溶液
c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某研究性學習小組設計以下裝置制取氯氣,并以氯氣為原料進行特定反應。分析并回答下列問題: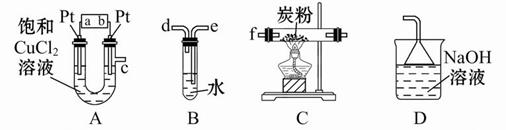
(1)裝置A中,b 為電池的 (填“正”或“負”)極。
(2)實驗開始時,先讓氯氣和水蒸氣充滿裝有炭粉的裝置C,再點燃C處的酒精燈,裝置C中發生氧化還原反應,生成CO2和HCl(g),則反應的化學方程式為:
。
(3)要將裝置B接入裝置A和C之間,正確的連接順序是:c→ → →f
(4)實驗結束后,將裝置B試管中的氯水倒入已檢查完好的分液漏斗中,然后再注入10 mL CCl4,蓋好玻璃塞,振蕩,靜置于鐵架臺上(如圖)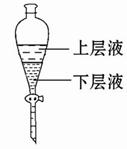
等分層后取上層液和下層液,呈黃綠色的是 (填“上層液”或“下層液”),該層液體能否使干燥的有色布條褪色? (填“能”或“不能”)。
(5)若裝置A中產生的氯氣恰好能與100 mL 4 mol/L的NaOH溶液完全反應,則此時A中Pt電極(陰極)增加的質量為 g。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com