
【題目】FeBr2是一種黃綠色固體,某學習小組制備并探究它的還原性。
【制備FeBr2固體】
實驗室用如圖所示裝置制取溴化亞鐵。其中A為CO2發生裝置,D和d中均盛有液溴,E為外套電爐絲的不銹鋼管,e是兩個耐高溫的瓷皿,其中盛有細鐵粉。
實驗開始時,先將干燥、純凈的CO2氣流通入D中,再將鐵粉加熱至600—700℃,E管中鐵粉開始反應。不斷將d中液溴滴入溫度為100—120℃的D中,經過一段時間的連續反應,在不銹鋼管內產生黃綠色鱗片狀溴化亞鐵。

(1)若在A中盛固體CaCO3,a中盛有6 mol/L的鹽酸。為使導入D中的CO2為干燥純凈的氣體,則圖中B、C處的洗氣瓶中裝有的試劑分別是:B中為____________,C中為_________________。
若進入E裝置中的CO2未干燥,則可能發生的副反應的化學方程式為_____________________。
(2)E管中的反應開始前通入CO2的主要作用是__________________________________;
E管中的反應開后持續通入CO2的主要作用是______________________________________。
【探究FeBr2的還原性】
(3)現實驗需要90 mL 0.1 mol/L FeBr2溶液,取上述反應制得的FeBr2固體配制該溶液,所需儀器除燒杯、量筒、玻璃棒外,還需要的玻璃儀器是_______________________________。
(4)已知:Cl2的CCl4溶液呈黃綠色,Br2的CCl4溶液呈橙紅色。Cl2既能氧化Br-,也能氧化Fe2+。
取10 mL上述FeBr2溶液,向其中滴加幾滴新制的氯水,振蕩后溶液呈黃色。取少量反應后的溶液加入KSCN溶液,溶液變為血紅色。另取少量反應后的溶液加入CCl4,振蕩后,下層為無色液體。
以上實驗結論表明還原性:Fe2+__________Br-(填“>”或“<”)。
(5)若在40 mL上述FeBr2溶液中通入標準狀況下67.2 mL的 C12,取少量反應后的溶液加入CCl4,振蕩后下層液體呈______色,寫出該反應的離子方程式________________________________。
【答案】 飽和NaHCO3溶液 濃硫酸 3Fe+ 4H2O ![]() Fe3O4+ 4H2 排盡裝置中原有的空氣 將溴蒸氣帶入E裝置中進行反應 膠頭滴管、100mL容量瓶 > 橙紅 4Fe2++2Br- +3Cl2 = 4Fe3++ Br2 + 6Cl-
Fe3O4+ 4H2 排盡裝置中原有的空氣 將溴蒸氣帶入E裝置中進行反應 膠頭滴管、100mL容量瓶 > 橙紅 4Fe2++2Br- +3Cl2 = 4Fe3++ Br2 + 6Cl-
【解析】
(1)裝置B用于除去二氧化碳中的氯化氫氣體,可以用盛有NaHCO3飽和溶液的洗氣瓶洗氣;裝置D作用是干燥二氧化碳,可以用盛有濃H2SO4的洗氣瓶干燥;若進入E裝置中的CO2未干燥,則可能發生的副反應的化學方程式為3Fe+ 4H2O ![]() Fe3O4+ 4H2溴蒸汽有毒,不能排到空氣中,可被堿液吸收,如氫氧化鈉溶液能夠與溴單質反應,適宜為防止污染空氣,實驗時應在F處連接盛有堿液如氫氧化鈉溶液的尾氣吸收裝置,故答案為:盛有飽和NaHCO3溶液的洗氣瓶;盛有濃H2SO4的洗氣瓶;NaOH溶液;
Fe3O4+ 4H2溴蒸汽有毒,不能排到空氣中,可被堿液吸收,如氫氧化鈉溶液能夠與溴單質反應,適宜為防止污染空氣,實驗時應在F處連接盛有堿液如氫氧化鈉溶液的尾氣吸收裝置,故答案為:盛有飽和NaHCO3溶液的洗氣瓶;盛有濃H2SO4的洗氣瓶;NaOH溶液;
(2)反應過程中要不斷地通入CO2,其主要作用是為:反應前將容器中的空氣趕凈,避免空氣中的氧氣干擾實驗;反應過程中要不斷通入CO2,還可以將Br2蒸氣帶入反應器D中,使溴能夠與鐵粉充分反應,故答案為:①排凈容器里的空氣;②將Br2蒸氣帶入反應器E中;
Ⅱ.(3)配制90 mL 0.1 mol/L FeBr2溶液FeBr2溶液時需要天平、鑰匙、燒杯、玻璃棒、100ml的容量瓶,膠頭滴管,則除燒杯、玻璃棒 量筒、外還需的玻璃儀器是,膠頭滴管、100ml的容量瓶;故答案為:100ml的容量瓶,膠頭滴管;
(4).取10 mL上述FeBr2溶液,向其中滴加幾滴新制的氯水,振蕩后溶液呈黃色。取少量反應后的溶液加入KSCN溶液,溶液變為血紅色,證明有Fe3+。另取少量反應后的溶液加入CCl4,振蕩后,下層為無色液體,實驗證明不存在單質溴,
以上實驗結論表明還原性:Fe2+>Br-。
(5)40 ml 0.1 mol/L FeBr2溶液含有FeBr2的物質的量為0.004mol,還原性Fe2+>Br-,二者以4:3反應,標準狀況下67.2 mL的 C12的物質量為0.003mol ,轉移電子0.003![]() =0.006mol由電子守恒可知,亞鐵離子全部被氧化,溴離子部分被氧化為Br2,所以加入CCl4,振蕩后下層液體呈橙色,反應的離子反應為4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-,故答案為:橙色 4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-。
=0.006mol由電子守恒可知,亞鐵離子全部被氧化,溴離子部分被氧化為Br2,所以加入CCl4,振蕩后下層液體呈橙色,反應的離子反應為4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-,故答案為:橙色 4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-。


科目:高中化學 來源: 題型:
【題目】下列哪種溶液中氯離子的物質的量濃度與50mL 0.5mol/L的氯化鋁溶液中氯離子的物質的量濃度相同( )
A. 30mL 0.5mol/L的氯化鎂溶液 B. 60mL 1.5mol/L的氯化鈉溶液
C. 20mL 0.1mol/L的氯化鉀溶液 D. 90mL 0.075mol/L 的氯化鈣溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應A+B=C的反應速率方程為v=kc(A)·c(B),v為反應速率,k為反應速率常數,是溫度的函數。當c(A)=c(B)=1 mol·L-1時,反應速率在數值上等于其反應速率常數。下列說法正確的是( )
A.只增大c(A)時,v增大
B.只增大c(C)時,v增大
C.只升高溫度時,k不變
D.只升高溫度時,k減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】立方烷(C8H8)、棱晶烷(C6H6)是近年來運用有機合成的方法制備的,具有如下圖所示立體結構的環狀有機物.萜類化合物是廣泛存在于動植物體內的一類有機物(例如盆烯、月桂烯、檸檬烯等). 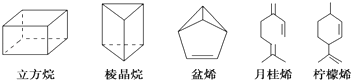
對上述有機物的下列說法中正確的是( )
①盆烯、月桂烯、檸檬烯都能使溴水褪色;
②棱晶烷、盆烯與苯互為同分異構體;
③月桂烯、檸檬烯互為同分異構體;
④立方烷、棱晶烷是環烷烴的同系物.
A.①②③
B.①②④
C.①③④
D.②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇,并開發出直接以甲醇為燃料的燃料電池.已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為﹣285.8kJmol﹣1、﹣283.0kJmol﹣1和﹣726.5kJmol﹣1 . 請回答下列問題:
(1)用太陽能分解10mol水消耗的能量是kJ.
(2)甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式為 .
(3)在容積為2L的密閉容器中,由CO2和H2合成甲醇,在其他條件不變得情況下,考察溫度對反應的影響,實驗結果如圖所示(注:T1、T2均大于300℃).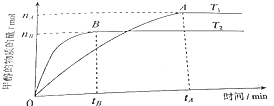
判斷該可逆反應達到化學平衡狀態的標志是(填字母).
①.v生成(CH3OH)=v消耗(CO2) ②.混合氣體的密度不再改變
③.CO2、H2、CH3OH的濃度均不再變化 ④.混合氣體的壓強不再改變
(4)在直接以甲醇為燃料電池中,電解質溶液為酸性,負極的反應式為、正極的反應式為 . 理想狀態下,該燃料電池消耗1mol甲醇所能產生的最大電能為702.1kJ,則該燃料電池的理論效率為(燃料電池的理論效率是指電池所產生的最大電能與燃料電池反應所能釋放的全部能量之比).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)NH3的摩爾質量為__________,3.4g NH3的物質的量為__________mol,該氣體在標準狀況下的體積為___________L。
(2)相同質量的O2和SO2,所含分子的數目之比為_____________,所含氧原子的物質的量之比為______________。
(3)實驗室需要0.10 mol/L的硫酸980mL,某同學欲用密度為1.84 g/cm![]() 、溶質的質量分數為98%的濃硫酸進行配制,需量取98%濃硫酸的體積為__________mL,若向容量瓶轉移溶液時,有少量液體濺出,則會使所配制的溶液物質的量濃度___________(填“偏高”,“偏低”或“不變”)。
、溶質的質量分數為98%的濃硫酸進行配制,需量取98%濃硫酸的體積為__________mL,若向容量瓶轉移溶液時,有少量液體濺出,則會使所配制的溶液物質的量濃度___________(填“偏高”,“偏低”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的轉化在給定條件下均能通過一步反應實現的是( )
A. NaAlO2(aq)![]() AlCl3
AlCl3![]() Al2O3 B. N2
Al2O3 B. N2![]() NO2
NO2![]() HNO3
HNO3
C. NaCl(飽和)![]() NaHCO3
NaHCO3![]() Na2CO3 D. FeS2
Na2CO3 D. FeS2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 氧化還原反應的本質是元素化合價的升降
B. 金屬陽離子被還原后,一定得到金屬的單質
C. 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出來
D. 四氯化碳和水混合后,可用分液的方法來分離
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com