
下表是元素周期表的一部分, 針對表中的①~⑩種元素,填寫下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | | | |||||
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | ⑦ | | ⑧ | ⑨ |
| 4 | ⑩ | | | | | | | |
| 電離能I(eV) | A | B | C | D | E |
| I1 | 11.3 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 113.9 | 138.3 | 141.3 | 153.7 |
(1)CH4 NH3 H2O (任寫兩種)。
(2)N>O>C> Na (寫元素符號)。
(3)HClO4 KOH電子式:
(4)Al2O3 Al2O3 +2OH- =2AlO 2-+H2O。
(5)A B; D的P軌道全空,能量更低更穩定。
解析試題分析:(1)①~⑩元素分別是H、C、N、O、Na、Al、P、Cl、Ar、K,由元素組成的分子中電子總數為10的分子有CH4 NH3 H2O HF等
(2)②、③、④、⑤元素分別是C、N、O、Na,根據電離能的遞變規律,N最外層半充滿,第一電離能最大,Na的電子層數最多,第一電離能最小,O、C位居其中,所以第一電離能的大小順序為N>O>C > Na
(3)元素的非金屬性越強,其最高價含氧酸的酸性越強,所以酸性最強是酸是氯元素對應的高氯酸,化學式為HClO4,金屬性越強,其最高價氧化物的水化物的堿性越強,所以堿性最強的堿是KOH,其電子式為
(4)具有兩性的最高價氧化物是Al2O3;其與氫氧化鈉溶液反應的離子方程式:Al2O3 +2OH- =2AlO 2-+H2O
(5)非金屬元素的第一電離能比較大,通過表中數據可以判斷第一電離能較大的為非金屬元素,AB可能屬于非金屬;E的前三電離能較小,第四電離能突然增大,說明此元素的化合價為+3,為鋁元素,而D的第一電離能比E略大且相鄰,所以D為鎂,原因是鎂的p軌道全空,能量更低更穩定
考點:考查元素周期表、元素周期律的應用,電子式、化學式、離子方程式的書寫,元素電離能的應用


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:填空題
下表為元素周期表的一部分,請回答有關問題:
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | ② | ③ | |
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
A、B、C、D、E是位于短周期的主族元素,其中A、B為金屬元素。已知:①熱穩定性:HmD>HmC;②Cm-、E(m-1)-具有相同的電子層結構;③B與E在同一周期,在該周期中,E的原子半徑最小,B的離子半徑最小;④A、B所形成的單核離子具有相同的電子層結構,B的最高價氧化物對應的水化物與A、E的最高價氧化物對應的水化物都能反應。依據上述信息用相應的化學用語回答下列問題:
(1)HmD的電子式:________。
(2)Cm-和E(m-1)-的還原性強弱為________>________,能證明其還原性強弱的離子方程式為________________________________________。
(3)寫出B的最高價氧化物對應的水化物和A的最高價氧化物對應的水化物反應的離子方程式_____________________________________。
(4)常溫下,將等物質的量濃度的HmC溶液和A的最高價氧化物對應的水化物溶液等體積混合,所得溶液顯堿性,溶液中離子濃度由大到小的順序為________。
(5)在B、C、E單質中,符合下列轉化關系的是________。
單質 化合物一
化合物一 化合物二
化合物二 最高價氧化物
最高價氧化物
對應的水化物
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)寫出表示含有8個質子,10個中子的原子的化學符號________;
(2)已知陰離子aX2-和陽離子bYn+具有相同的核外電子排布,則a、b、n之間的關系為a=________;
(3)比較下列大小(填“>”或“<”)
A.原子半徑:Cl______Na
B.酸性:H2CO3______H2SiO3
(4)某元素R氣態氫化物的化學式為RH3,其最高價氧化物中含氧量為 ,已知該元素的原子核中中子數和質子數相等,則該元素的名稱是________。
,已知該元素的原子核中中子數和質子數相等,則該元素的名稱是________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
I.已知幾種元素原子的價電子構型為3s2,4s2,4s24p1,3d54s2,3s23p3,它們分別屬于第幾周期?第幾族?最高化合價是多少?各元素符號分別是什么?
Ⅱ.第四周期的A、B、C、D四種元素,其價電子數依次為1、2、2、7,其原子序數依次增大。已知A與B 的次外層電子數均為8,而C與D的次外層電子數均為18。根據原子結構,判斷:
(1)A、B、C、D的元素符號分別是________、________、________、________。
(2)寫出D與A的簡單離子的電子排布式________,________。
(3)哪一種元素的氫氧化物堿性最強?__________________________________________。
(4)B與D兩原子間能形成何種化合物?________________。寫出化學式及電子式________________,________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
X、Y、Z、W是元素周期表前四周期中常見的元素,其相關信息見下表:
| 元素 | 相關信息 |
| X | X的基態原子核外的三個能級上電子數相等 |
| Y | Y與X同周期,Y基態原子p能級的成對電子數與未成對電子數相等 |
| Z | Z的單質是一種銀白色活潑金屬,在空氣中燃燒后生成淡黃色的固體 |
| W | 向含W2+的溶液中滴加強堿,其白色氫氧化物在空氣中迅速變成灰綠色,最后變成紅褐色 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
元素周期表是學習化學的重要工具,它隱含著許多信息和規律。下表所列是五種短周期元素的原子半徑及主要化合價(已知鈹的原子半徑為0.089 nm)。
| 元素代號 | A | B | C | D | E |
| 原子半徑/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合價 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
為保持街道整潔、濕潤,在路面或廣場上噴灑含化學式為XY2的溶液作保濕劑。X原子的結構示意圖為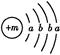 ,X的陽離子與Y的陰離子的電子層結構相同。元素Z、W均為短周期元素,它們原子的最外層電子數均是其電子層數的2倍,Z與Y相鄰且Z、W能形成一種WZ2型分子。
,X的陽離子與Y的陰離子的電子層結構相同。元素Z、W均為短周期元素,它們原子的最外層電子數均是其電子層數的2倍,Z與Y相鄰且Z、W能形成一種WZ2型分子。
(1)m= ,該保濕劑的化學式為
(2)Z、W元素的名稱為 、
(3)下列說法中正確的是
A.XY2和WZ2都為離子化合物
B.XY2中僅含離子鍵,WZ2中僅含極性共價鍵
C.H2Z比HY的穩定性強
D.X的陽離子比Y的陰離子半徑大
(4)下列化學用語表達正確的是
A.XY2的電子式:X2+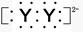
B.WZ2的結構式:Z=W=Z
C.Y元素的單質與H2Z水溶液反應的離子方程式為:Y2+Z2- 2Y-+Z↓
2Y-+Z↓
D.用電子式表示XY2的形成過程為: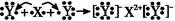
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下列關于元素周期律和元素周期表的論述中正確的是( )。
| A.同一主族的元素從上到下金屬性逐漸減弱 |
| B.元素周期表是元素周期律的具體表現形式 |
| C.同一周期從左到右,元素原子半徑逐漸增大 |
| D.非金屬元素的最高正化合價等于它的負化合價的絕對值 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com