
【題目】亞硝酰氯(NOCl,熔點:-64.5℃,沸點:-5.5℃)是一種黃色氣體,遇水易水解。可用于合成清潔劑、觸媒劑及中間體等。實驗室可由氯氣與一氧化氮在常溫常壓下合成。
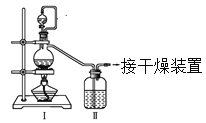
(1)甲組的同學擬制備原料氣NO和Cl2,制備裝置如下圖所示:
為制備純凈干燥的氣體,下表中缺少的藥品是:
裝置Ⅰ | 裝置Ⅱ | ||
燒瓶中 | 分液漏斗中 | ||
制備純凈Cl2 | MnO2 | ①________ | ②________ |
制備純凈NO | Cu | ③________ | ④________ |
(2)乙組同學利用甲組制得的NO和Cl2制備NOCl,裝置如圖所示:
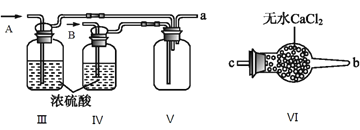
①為了使氣體充分反應,從A處進入的氣體是____________(填Cl2或NO)。
②裝置連接順序為a→_______________________(按氣流自左向右方向,用小寫字母表示)。
③裝置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一個作用是________________________。
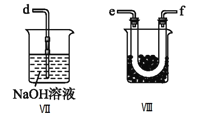
④裝置Ⅷ的燒杯中盛放的試劑是_____________________(填編號①水②冰水③冰鹽水)
⑤裝置Ⅶ中吸收尾氣時,NOCl發生反應的化學方程式為___________________________________。
(3)丙組同學查閱資料,查得王水是濃硝酸與濃鹽酸的混酸,一定條件下混酸可生成亞硝酰氯和氯氣,該反應的化學方程式為________________________________。
【答案】 濃鹽酸 飽和食鹽水 稀硝酸 水 Cl2 e→f→c→b→d 通過觀察氣泡調節氣體流速 ③ NOCl+2NaOH=NaCl+NaNO2+H2O HNO3(濃)+3HCl(濃)![]() NOCl↑+Cl2↑+2H2O
NOCl↑+Cl2↑+2H2O
【解析】試題分析:本題考查Cl2、NO和NOCl的制備,實驗裝置的連接,方程式的書寫。
(1)制備Cl2的反應原理為:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O。①制備Cl2時分液漏斗中盛放濃鹽酸。②由于鹽酸具有揮發性,上述方法制得的Cl2中混有HCl、H2O(g),為了除去Cl2中的HCl,裝置II中盛放飽和食鹽水。
MnCl2+Cl2↑+2H2O。①制備Cl2時分液漏斗中盛放濃鹽酸。②由于鹽酸具有揮發性,上述方法制得的Cl2中混有HCl、H2O(g),為了除去Cl2中的HCl,裝置II中盛放飽和食鹽水。
制備NO的反應原理為:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。③制備NO時分液漏斗中盛放稀硝酸。④因為裝置中有空氣,制得的NO與O2反應生成NO2,NO中混有NO2,為了除去NO2,裝置II中盛放H2O,反應的化學方程式為3NO2+H2O=2HNO3+NO。
(2)①NO的密度小于Cl2的密度,為了使氣體充分反應,從短管進入Cl2,從A處進入的氣體是Cl2。
②在裝置V中NO與Cl2合成NOCl,NOCl是一種黃色氣體,沸點為-5.5℃,在裝置VIII中將NOCl冷凝,NOCl遇水易水解,在裝置VIII后面連接裝置VI,由于Cl2、NO、NOCl會污染大氣,最后連接裝置VII吸收尾氣;裝置連接順序為a→e→f→c→b→d。
③裝置III、IV除可干燥NO、Cl2外,另一個作用是:通過觀察氣泡調節氣體流速。
④裝置VIII的燒杯中盛放的試劑將NOCl冷凝為液體,NOCl的沸點為-5.5℃,應選擇冰鹽水,答案選③。
⑤NOCl遇水易水解,則NOCl與NaOH溶液反應生成NaNO2、NaCl和H2O,反應的化學方程式為NOCl+2NaOH=NaNO2+NaCl+H2O。
(3)根據資料寫出反應HNO3(濃)+HCl(濃)![]() NOCl↑+Cl2↑,N元素的化合價由+5價降至+3價,Cl元素的化合價由-1價升至0價,根據得失電子守恒、結合原子守恒,寫出反應的化學方程式為HNO3(濃)+3HCl(濃)
NOCl↑+Cl2↑,N元素的化合價由+5價降至+3價,Cl元素的化合價由-1價升至0價,根據得失電子守恒、結合原子守恒,寫出反應的化學方程式為HNO3(濃)+3HCl(濃)![]() NOCl↑+Cl2↑+2H2O。
NOCl↑+Cl2↑+2H2O。


科目:高中化學 來源: 題型:
【題目】如圖是一個化學過程的示意圖。
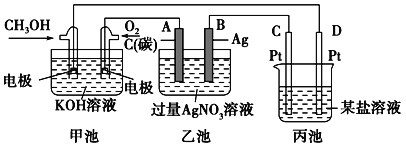
(1)甲池中OH-移向__________極(填“CH3OH”或“O2”)。
(2)寫出通入CH3OH的電極的電極反應式_______________。
(3)乙池中總反應的離子方程式___________________。
(4)當乙池中B(A g)極的質量增加5.40g,若此時乙池中溶液的體積為500ml,則溶液的pH是___________;此時丙池某電極析出1.60g某金屬,則丙中的某鹽溶液可能是______________(填序號)。
A. MgSO4 B. CuSO4 C. NaCl D. AgNO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】芳香化合物A是一種基本化工原料,可以從煤和石油中得到。A、B、C、D、E的轉化關系如下所示:
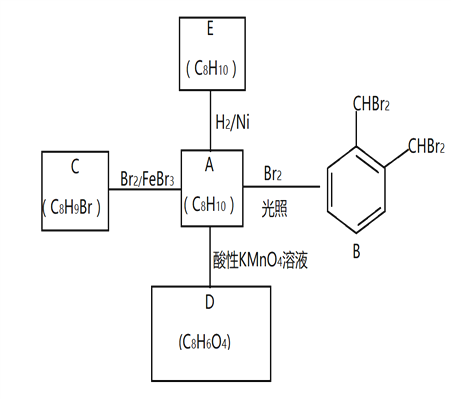
回答下列問題:
(1)A的化學名稱是___________
(2)A→B 的反應類型是______________。在該反應的副產物中,與B互為同分異構體的副產物的結構簡式為______________________
(3)C中官能團名稱_____________;A與酸性KMnO4溶液反應可得到D,寫出D中官能團名稱_______________________________
(4)A→E的化學方程式為____________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.根據下表所示化學反應與數據關系,回答下列問題:
化學反應 | 平衡常數 | 溫度 | |
973 K | 1173 K | ||
①Fe(s)+CO2(g)FeO(s)+CO(g) | K1 | 1.50 | 2.15 |
②Fe(s)+H2O(g)FeO(s)+H2(g) | K2 | 2.40 | 1.67 |
③CO(g)+H2O(g)CO2(g)+H2(g) | K3 | ? | ? |
(1)反應①是________(填“吸熱”或“放熱”)反應。
(2)在973K時,K3=_________。
(3)要使反應③在一定條件下建立的平衡向逆反應方向移動,可采取的措施有______(填寫字母序號)。
A.縮小反應容器的容積 B.擴大反應容器的容積 C.升高溫度
D.使用合適的催化劑 E.設法減小平衡體系中的CO濃度
Ⅱ.無機和有機氰化物在工農業生產中應用廣泛,尤其是冶金工業常用的氰化物,含氰廢水的處理顯得尤為重要。含氰廢水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工業上有多種廢水處理方法。
(1)電解處理法:
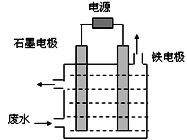
用如圖所示裝置處理含CN-廢水時,控制溶液pH為9~10并加入NaCl,一定條件下電解,陽極產生的ClO-將CN-氧化為無害物質而除去。鐵電極為__________(填“陰極” 或“陽極”),陽極產生ClO-的電極反應為__________________________,陽極產生的ClO-將CN-氧化為無害物質而除去的離子方程式為__________________________。
(2)UV(紫外光線的簡稱)—H2O2氧化法。
實驗過程:取一定量含氰廢水,調節pH,加入一定物質的量的H2O2,置于UV工藝裝置中,
光照一定時間后取樣分析。
【查閱資料】
①在強堿性溶液中4[Fe(CN)6]3-+4OH-===4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更穩定;
②[Fe(CN)6]3-轉化為CN-容易被H2O2除去;
③HCN是有毒的弱酸,易揮發。
【問題設計】
①請寫出HCN的電子式________________。
②含氰廢水在不同pH下的除氰效果如圖所示,pH選擇的最佳范圍應為________________(選填編號:![]() .7~10;
.7~10;![]() .10~11;
.10~11;![]() .11~13),解釋該pH不宜太大的原因___________________。
.11~13),解釋該pH不宜太大的原因___________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中,不正確的是
A. 共價化合物可能含有離子鍵
B. CCl4和NH3都是只含有極性鍵的共價化合物
C. Na2O2是含有非極性鍵的離子化合物
D. CaO和NaCl晶體熔化時要破壞離子鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某有機物A的紅外光譜和核磁共振氫譜如圖所示,下列說法中錯誤的是( )

A. 由紅外光譜可知,該有機物中至少有三種不同的化學鍵
B. 由核磁共振氫譜可知,該有機物分子中有三種不同化學環境的氫原子
C. 僅由其核磁共振氫譜無法得知其分子中的氫原子總數
D. 若A的化學式為C2H6O,則其結構簡式為CH3—O—CH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.ⅠA、ⅡA族元素的原子,其半徑越大,越難失去電子
B.元素周期表中共有18個縱行,但僅有15個族
C.原子的核外電子層數等于該元素所在的周期數
D.原子最外層電子數等于該元素所在的族序數
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com