
【題目】X、Y、Z、Q、R為原子序數依次增大的短周期主族元素,其原子半徑與最外層電子數的關系如下圖所示。R原子最外層電子數Q原子最外層電子數的4倍,Q的簡單離子核外電子排布與Z2-相同。下列相關敘述不正確的是

A. 化合物![]() 中含有離子鍵
中含有離子鍵
B. 五種元素中Q的金屬性最強
C. 氣態氫化物的穩定性:![]()
D. 最高價氧化物對應的水化物酸性:![]()
【答案】A
【解析】
X、Y、Z、Q、R為原子序數依次增大的短周期主族元素,R原子最外層上的電子數是Q原子最外層電子數的4倍,則Q只能處于IA族,R處于ⅣA族,R與X最外層電子數相同,二者同主族,且R的原子半徑較大,故X為C元素、R為Si元素;最外層電子數Z>Y>4,且二者原子半徑小于碳原子,故Y、Z處于第二周期,Z能夠形成離子Z2-,故Z為O元素,則Y為N元素;Q離子核外電子排布與O2-相同,且Q處于IA族,故D為Na,據此進行解答。
根據上述分析可知X是C元素,Y是N元素,Z是O元素,R是Si元素,Q是Na元素。
A.化合物XZ2是CO2,該物質是共價化合物,由分子構成,分子中含有共價鍵,A錯誤;
B.在上述五種元素中只有Q表示的Na元素是金屬元素,因此五種元素中Q的金屬性最強,B正確;
C.元素的非金屬性越強,其簡單氫化物的穩定性就越強。由于元素的非金屬性N>C,所以氫化物的穩定性NH3>CH4,C正確;
D.元素的非金屬性越強,其最高價氧化物對應的水化物的酸性就越強。由于元素的非金屬性N>Si,所以酸性:HNO3>H2SiO3,D正確;
故合理選項是A。


科目:高中化學 來源: 題型:
【題目】高鐵電池是一種新型可充電電池,與普通高能電池相比,該電池長時間保持穩定的放電電壓。高鐵電池的總反應為:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列敘述不正確的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列敘述不正確的是
A. 放電時負極反應為:Zn-2e-+2OH-=Zn(OH)2
B. 充電時陽極反應為:Fe(OH)3-3e-+5OH-=![]() +4H2O
+4H2O
C. 放電時每轉移3 mol電子,正極有1 mol K2FeO4被氧化
D. 放電時正極附近溶液的堿性增強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)鑒別KCl溶液和K2CO3的試劑名稱是_______,離子方程式為_____________。
(2)除去混入NaCl溶液中少量NaHCO3雜質的試劑名稱是_______________,離子方程式為_____________________________。
(3)除去Na2CO3粉末中混入的NaHCO3雜質用___________方法,化學方程式為______________________________________________。
(4)除去鐵粉中混有鋁粉的試劑名稱是_______,化學方程式為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:A、B、F是家庭中常見的有機物,F常用于食品包裝,E是石油化工發展水平的標志。根據下面轉化關系回答問題。

(1)分別寫出A和E中官能團的名稱:A中_________;E中_________;
(2)操作⑥的名稱為________________。
(3)寫出反應類型:④_________;
(4)請寫出下列反應的化學方程式:
①寫出A和B在濃硫酸中加熱反應的方程式_________________;
②B在金屬銅存在下在空氣中加熱反應________________;
(5)F是一種常見的高分子材料,它給我們帶來了巨大的方便。然而,這種材料造成的當今的某一環境問題是__________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于電子式的表述正確的是( )
A.HClO的電子式為
B.SCl2的電子式為
C.用電子式表示HCl的形成過程為
![]()
D.已知SCN-每個原子都達到8電子結構,則其電子式為
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,向10 mL ![]() 溶液中滴加
溶液中滴加![]() 的
的![]() 溶液,滴加過程中,溶液中
溶液,滴加過程中,溶液中![]() 與
與![]() 溶液體積(V)的關系如圖所示,下列說法正確的是( )已知:
溶液體積(V)的關系如圖所示,下列說法正確的是( )已知: ![]() 。
。
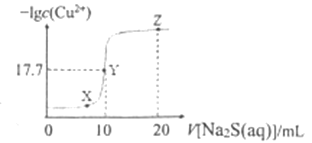
A. 該溫度下 ![]()
B. X、Y、Z三點中,Y點水的電離程度最小
C. ![]() 溶液中:
溶液中:![]()
D. 向100 mL ![]() 濃度均為
濃度均為![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的
的![]() 溶液,
溶液,![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是應用廣泛的化工原料和前景樂觀的無色液體燃料。請按要求回答下列問題。
(1)已知25℃、101 kpa時一些物質的燃燒熱如下表:
物質 | CH3OH(l) | CO(g) | H2(g) |
燃燒熱/(kJ/mol) | 726.8 | 283.0 | 285.8 |
寫出由CO和H2反應生成CH3OH(l)的熱化學方程式: _________________________。
(2)一定溫度下,在容積為2L的恒容密閉容器中進行反應:CO(g)+2H2(g)=CH3OH(g),其相關數據如圖所示。

①從反應開始至5min時,用CH3OH表示的反應平均速度為____________。
②圖中反應達平衡時,K=_______(mol/L)-2;CO的平衡轉化率為________________。
(3)人們利用甲醇制得能量轉化率高、對環境無污染的燃料電池,其工作原理如圖所示,該裝置工作時,a極反應式為____________________。

若用該電池及惰性電極電解2L飽和和食鹽水產生224mL(標準誤差2)Cl2時(假設全部句逸出并收集,忽略溶液體積的變化),常溫下所得溶液的pH為________。
(4)甲醇在一定條件下可轉化為甲酸。常溫下,向0.1mol/L HCOOH溶液中滴加0.1mol/LNaOH溶液至pH=7[已知,K(HCOOH)=1.8×10-4]。此時混合游學中兩溶質的物質的量之比n(HCOOH):n(HCOONa)____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學為了探究氯化銨的性質,進行了如下實驗,請你按要求回答下列問題。
(1)配制100mL 2mol/L的NH4Cl溶液。該同學應用天平稱量NH4Cl固體的質量為______g。
(2)有以下儀器:燒杯、膠頭滴管、玻璃棒、量筒等玻璃儀器。
①還缺少的玻璃儀器有__________;
②使用此儀器前必須進行的一步操作是_______;
(3)該同學又用如圖所示的裝置收集干燥純凈的氨氣并做性質實驗:

①寫出A處氯化銨與熟石灰反應的化學方程式:______________
②B中盛放的是__________其作用是__________
③氨水中滴加酚酞溶液變為________色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應4A(g)+5B(g)=4C(g)+6D(g),在5L的密閉容器中進行,半分鐘后,C的物質的量增加了0.30mol。下列敘述正確的是( )
A.容器中含D物質的量至少為0.45mol
B.A的平均反應速率是![]()
C.容器中A、B、C、D的物質的量之比一定是4:5:4:6
D.容器中A的物質的量一定增加了0.30mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com