
【題目】Ⅰ. 工業上可通過CO和H2化合制得CH3OH: CO(g)+2H2(g) ![]() CH3OH(g) ΔH (CO結構式為C≡O)。又知某些化學鍵的鍵能(斷開 1 mol化學鍵時所需要的最低能量)數值如下表:
CH3OH(g) ΔH (CO結構式為C≡O)。又知某些化學鍵的鍵能(斷開 1 mol化學鍵時所需要的最低能量)數值如下表:
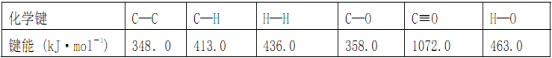
則ΔH =_____________,在相應的反應條件下,將 1 mol CO(g)與足量H2混合充分反應后,則放出或吸收的熱量Q ________ ΔH 的數值(填“>”、“=”或“<”)。
Ⅱ.電化學降解NO3-的原理如右圖所示。

①電源 A 極為________(填“正極”或“負極”),陰極反應式為_______________。
②若電解過程中轉移了 1 mol 電子,則膜左側電解液的質量減少量為________g。
Ⅲ.已知NO2和N2O4的相互轉化反應:2NO2(g)![]() N2O4(g) ΔH<0。現將一定量NO2和N2O4的混合氣體通入一體積為 2L的恒溫密閉玻璃容器中,反應物濃度隨時間變化關系如下圖:
N2O4(g) ΔH<0。現將一定量NO2和N2O4的混合氣體通入一體積為 2L的恒溫密閉玻璃容器中,反應物濃度隨時間變化關系如下圖:

①圖中共有兩條曲線X和Y,其中曲線________表示NO2濃度隨時間的變化。下列不能說明該反應已達到平衡狀態的是________。
A. 容器內混合氣體的壓強不隨時間變化而改變
B. 容器內混合氣體的密度不隨時間變化而改變
C. 容器內混合氣體的顏色不隨時間變化而改變
D. 容器內混合氣體的平均分子量不隨時間變化而改變
②前 10 min內用NO2表示的化學反應速率v(NO2)=________mol/(L·min)。
③反應 25 min 時,若只改變了某一個條件,使曲線發生如上圖所示的變化,該條件可能是_____________(用文字表達);其平衡常數 K(d)________K(b)(填“>”、“=”或“<”)。
【答案】
Ⅰ、-116 kJmol-1;<;
Ⅱ、①正極;2NO3-+10e-+12H+=6H2O+N2↑;②9g;
Ⅲ、①X;B;②0.04;③增大NO2的濃度;=;
【解析】
試題分析:Ⅰ.CH3OH:CO(g)+2H2(g)═CH3OH(g)中的焓變△H1=反應物總鍵能-生成物總鍵能,依據圖表提供的化學鍵的鍵能計算得到△H1 ═ 1072 kJmol-1 + 2 × 436 kJmol-1-(3 × 413 kJmol-1 + 358 kJmol-1 + 463 kJmol-1) = -116 kJmol-1;由于是可逆反應,平衡時1mol CO(g)反應后生成的CH3OH小于1mol,所以放出的熱量小于116 kJ,故答案為:-116 kJmol-1;<;
Ⅱ、由圖示知在Ag-Pt電極上NO3-發生還原反應,因此Ag-Pt電極為陰極,則B為負極,A為電源正極,在陰極反應是NO3-得電子發生還原反應生成N2,利用電荷守恒與原子守恒知有H2O參與反應且有水生成,所以陰極上發生的電極反應式為:2NO3-+12H++10e-=N2+6H2O,故答案為:正極;2NO3-+10e-+12H+=6H2O+N2↑;
②由圖示知在Ag-Pt電極上NO3-發生還原反應,因此Ag-Pt電極為陰極,則B為負極,A為電源正極,轉移1mol電子時,陽極(陽極反應為H2O失電子氧化為O2和H+)消耗0.5mol水,產生1molH+進入陰極室,陽極室質量減少9g,故答案為:9 g;
Ⅲ.①由圖可知10-25min平衡狀態時,X表示的生成物的濃度變化量為(0.6-0.2)mol/L=0.4mol/L,Y表示的反應物的濃度變化量為(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的濃度變化量是Y表示的反應物的濃度變化量的2倍,所以X表示NO2濃度隨時間的變化曲線,Y表示N2O4濃度隨時間的變化曲線;容器內混合氣體的體積不變,質量不變所以密度不變,因此,密度不能判斷平衡;故答案為:X;B;
②X表示NO2濃度隨時間的變化曲線,Y表示N2O4濃度隨時間的變化曲線.由圖可知,前10min內,NO2的濃度變化量為(0.6-0.2)mol/L=0.4mol/L,所以υ(NO2)=![]() =0.04molL-1min-1,故答案為:0.04;
=0.04molL-1min-1,故答案為:0.04;
③由曲線看出25 min時,NO2的濃度突然增大,可知改變的條件為增大NO2的濃度;溫度不變,化學平衡常數不變;故答案為:增大NO2的濃度;=;


 金版課堂課時訓練系列答案
金版課堂課時訓練系列答案 單元全能練考卷系列答案
單元全能練考卷系列答案 新黃岡兵法密卷系列答案
新黃岡兵法密卷系列答案科目:高中化學 來源: 題型:
【題目】在一個固定容積的密閉容器中,保持一定溫度進行如下反應:H2(g)+Br2(g) ![]() 2HBr(g),已知加入1 mol H2和2 mol Br2達到平衡后,生成x mol HBr,在相同條件下若起始時加入的H2、Br2、HBr分別為a、b、c(均不為0)且保持平衡時,各組分含量都不變,以下推斷正確的是 ( )
2HBr(g),已知加入1 mol H2和2 mol Br2達到平衡后,生成x mol HBr,在相同條件下若起始時加入的H2、Br2、HBr分別為a、b、c(均不為0)且保持平衡時,各組分含量都不變,以下推斷正確的是 ( )
①a、b、c應滿足的關系是4a+c=2b
②平衡時HBr為ax mol
③a、b、c應滿足的關系是a+b=c
④平衡時HBr為![]() x mol
x mol
A.① B.①② C.①④ D.②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列有關圖象,說法正確的是( )
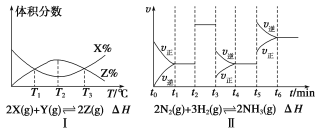

①由圖Ⅰ知,反應在T1、T3處達到平衡,且該反應的ΔH<0
②由圖Ⅱ知,反應在t6時刻,NH3體積分數最大
③由圖Ⅱ知,t3時采取減小反應體系壓強的措施
④圖Ⅲ表示在10 L容器、850 ℃時的反應,由圖知,到4 min 時,反應放出51.6 kJ的熱量
A.①③ B.②④ C.③④ D.②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家制造出一種使用固體電解質的燃料電池,其效率更高,可用于航天航空。
如圖1所示裝置中,以稀土金屬材料作惰性電極,在兩極上分別通入CH4和空氣,其中固體電解質是摻雜了Y2O3的ZrO2固體,它在高溫下能傳導陽極生成的O2-(O2+4e-=2O2-)。

(1)d電極的名稱為___________,d電極上的電極反應式為____________________
(2)如圖2所示用惰性電極電解100 mL 0.5 mol·L-1 AgNO3溶液,a電極上的電極反應式為___________,若a電極產生560mL(標準狀況)氣體,則所得溶液的C(H+)=___________(不考慮溶液體積變化),若要使電解質溶液恢復到電解前的狀態,可加入_________(填序號)其物質的量為_______mol
a Ag2O b.AgOH c.AgNO3 d.Ag2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO![]() )=6 mol/L,用石墨作電極電解此溶液,當通電一段時間后,兩極均收集到氣體22.4 L(標準狀況下),假定電解后溶液體積仍為500 mL,下列說法正確的是( )
)=6 mol/L,用石墨作電極電解此溶液,當通電一段時間后,兩極均收集到氣體22.4 L(標準狀況下),假定電解后溶液體積仍為500 mL,下列說法正確的是( )
A.原混合溶液中c(Na+)=6 mol
B.電解后得到的Cu的物質的量為2 mol
C.上述電解過程中共轉移8 mol電子
D.電解后溶液中c(H+)=4 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把3molP和2.5molQ置于密閉容器中,發生如下反應:3P(g)+Q(g)![]() xM(g)+2N(g),5min后達到平衡生成1molN,經測定M的平均速率是0.1mol/(L·min),下列敘述不正確的是
xM(g)+2N(g),5min后達到平衡生成1molN,經測定M的平均速率是0.1mol/(L·min),下列敘述不正確的是
A.P的平均反應速率為0.15mol/(L·min)
B.Q的平衡濃度為1mol/L
C.Q的轉化率為25%
D.x等于2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以![]() 表示阿伏加德羅常數,下列說法中正確的是
表示阿伏加德羅常數,下列說法中正確的是
A.58.5 g氯化鈉固體中含有![]() 個氯化鈉分子
個氯化鈉分子
B.1 mol Fe參與反應失去電子數目一定為2![]()
C.1 molNa被完全氧化生成Na202,失去2![]() 個電子
個電子
D.常溫下,46 g N02和N204的混合物中含有的氮原子數為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【選修3:物質結構與性質】(15分)A、B、C、D、E、F、G是前四周期(除稀有氣體)原子序數依次增大的七種元素,A的原子核外電子只有一種運動狀態;B、C的價電子層中未成對電子數都是2;B、C、D同周期;E核外的s、p能級的電子總數相籌;F與E同周期且第一電離能比E小;G的+1價離子(G+)的各層電子全充滿。回答下列問題:(相關問題用元素符號表示)
(1)寫出E的基態原子的電子排布式______________________。
(2)B與C可形成化合物BC和BC2,BC2屬于__________(填“極性”、“非極性”)分子,1 mol BC含有π鍵為____________mol。
(3)由元素A、C、G組成的離子[G(A2C)4]2+在水溶液中顯天藍色,不考慮空間結構,[G(A2C)4]2+的結構可用示意圖表示為__________(配位鍵用→標出)。
(4)測定A、D形成的化合物的相對分子質量時,實驗測定值一般高于理論值的原因是_________________。
(5)由元素A、B、F組成的原子個數比9 : 3 : 1的一種物質,分子中含三個相同的原子團,其結構簡式為___________,分子中F原子的雜化方式為__________,該物質遇水爆炸,生成白色沉淀和無色氣體,反應的化學方程式為_____________。

(6)G與氮元素形成的某種化合物的晶胞結構如右圖,則該化合物的化學式為__________,若晶體密度為a g·cm-3,列式計算G原子與氮原子最近的距離為__________pm(不必計算出數值,阿伏加德羅常數的值用NA表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com