
【題目】某學生需要用燒堿固體配制0.5mol·L-1的NaOH溶液480mL。實驗室提供以下儀器:
①100mL燒杯 ②100mL量筒 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盤天平(帶砝碼) ⑦藥匙。請回答下列問題:
(1)計算需要稱取NaOH固體_________g。
(2)配制時,必須使用的儀器有_______(填代號),還缺了儀器名稱是_________。
(3)配制時,其正確的操作順序是(字母表示,每個操作只用一次)________。
A.用少量水洗滌燒杯2~3次,洗滌液均注入容量瓶,振蕩
B.在盛有NaOH固體的燒杯中加入適量水溶解
C.將燒杯中已冷卻的溶液沿玻璃棒注入容量瓶中
D.將容量瓶蓋緊,反復上下顛倒,搖勻
E.改用膠頭滴管加水,使溶液凹面恰好與刻度相切
F.繼續往容量瓶內小心加水,直到液面接近刻度1~2cm處
(4)若出現如下情況,其中將引起所配溶液濃度偏高的是___。(填下列編號)
①容量瓶實驗前用蒸餾水洗干凈,但未烘干 ②定容觀察液面時俯視
③配制過程中遺漏了(3)中步驟A ④加蒸餾水時不慎超過了刻度
⑤未等NaOH溶液冷卻至室溫就轉移到容量瓶中
(5)用配制好的溶液,再來配制50ml0.2mol·Lˉ1的NaOH溶液,需要取原配好的溶液_____ml。
【答案】10.0 ①④⑤⑥⑦ 膠頭滴管 BCAFED ②⑤ 20
【解析】
(1)根據m=nM=cVM計算;
(2)根據實驗操作的步驟以及每步操作需要儀器確定反應所需儀器;
(3)根據實驗操作的步驟;
(4)根據c=![]() 分析操作對溶質的物質的量或對溶液的體積的影響判斷;
分析操作對溶質的物質的量或對溶液的體積的影響判斷;
(5)根據溶液在稀釋前后溶質的物質的量不變計算。
(1)實驗室配制0.5mol/L的NaOH溶液500mL,需要NaOH的質量m(NaOH)=0.5L×0.5mol/L×40g/mol=10.0g;
(2)操作步驟有計算、稱量、溶解、移液、洗滌、定容、搖勻等操作,一般用托盤天平稱量,用藥匙取用藥品,在燒杯中溶解,冷卻后轉移到500mL容量瓶中,并用玻璃棒引流,當加水至液面距離刻度線1~2cm時,改用膠頭滴管滴加,所以還需要的儀器為膠頭滴管,故使用儀器的序號是①④⑤⑥⑦;缺少的儀器是膠頭滴管;
(3)操作步驟有稱量、溶解、移液、洗滌、定容、搖勻等操作,故答案為:BCAFED;
(4)①容量瓶實驗前用蒸餾水洗干凈,但未烘干,不影響溶質的質量和溶液的體積,因此對溶液的濃度不產生任何影響,物質的濃度不變,①不符合題意;
②定容觀察液面時俯視,溶液體積偏小,則溶液的濃度偏大,②符合題意;
③配制過程中遺漏了(3)中步驟A,溶質的質量減少,導致溶液的濃度偏低,③不符合題意;
④加蒸餾水時不慎超過了刻度,溶液體積偏大,導致溶液的濃度偏小,④不符合題意;
⑤未等NaOH溶液冷卻至室溫就轉移到容量瓶中,導致溶液的體積偏小,則溶液的濃度偏大,⑤符合題意;
故合理選項是②⑤;
(5)由于溶液在稀釋前后溶質的物質的量不變,所以50ml×0.2mol/L =0.5mol/L×V,解得V=20mL。


科目:高中化學 來源: 題型:
【題目】某烴結構式如圖所示,有關其結構說法正確的是( )

A. 所有原子可能在同一平面上B. 最多有7個碳原子在同一條直線上
C. 所有碳原子可能在同一平面上D. 1 mol 該烴最多可與3 mol氫氣反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)3.6g H2O的物質的量是________,含有________個H2O,含有________molH。
(2)0.1molAl2(SO4)3中含有Al3+________mol、SO42- ________個。
(3)2 mol O3和3mol O2的質量之比為__________。
(4)9.5gMgCl2固體溶于水配成500mL溶液,濃度為______molL1,從中取出100mL溶液,其中Cl的濃度為_____molL1;再把取出的溶液加水稀釋成500mL,則此時MgCl2溶液的濃度為______molL1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化還原反應在日常生活和生產中應用廣泛,結合相關知識回答下列問題:
I.根據反應①~③,回答下列問題:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3 ③2FeCl3+2HI=2FeCl2+2HCl+I2
(1)反應②的反應類型為___(填字母)。
A.置換反應 B.復分解反應 C.分解反應 D.氧化還原反應
(2)對于反應③,氧化產物是___,還原產物是___。
(3)根據上述三個反應可判斷出Cl-、I-、Fe2+三種物質的還原性由強到弱順序為___。
II.實驗室可以用 KMnO4固體和濃鹽酸反應制取少量Cl2,反應的化學方程式為:__KMnO4+__HCl(濃)-__KCl+__MnCl2+__Cl2↑+__H2O,回答下列問題:
(1)請配平上述化學方程式。___
(2)濃鹽酸在反應中表現的性質是___。
(3)該反應中氧化劑和還原劑的物質的量之比為___。
III.飲用水中NO3-對人類健康會產生危害,為了降低飲用水中NO3-的濃度,某飲用水研究人員提出,在堿性條件下用鋁粉將NO3-還原為N2,其化學方程式為:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,請回答下列問題:
(1)上述反應中,被還原的物質是___。
(2)用雙線橋標出反應中電子轉移的方向和數目。___
(3)上述反應中若標準狀況下產生11.2L氣體,則轉移電子的數目為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯環結構中,不存在碳碳單鍵和碳碳雙鍵的簡單交替結構,可以作為證據的事實是( )
①苯不能使酸性KMnO4溶液褪色
②苯分子中碳碳鍵的長度完全相等
③苯能在加熱和催化劑存在的條件下與氫氣發生反應生成環己烷(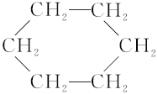 )
)
④經實驗測得對二甲苯(![]() )只有一種結構
)只有一種結構
⑤苯在溴化鐵作催化劑條件下同液溴可發生取代反應,但不能因化學反應而使溴水褪色
A. ②③④B. ②④⑤C. ①③⑤D. ①②⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂電池作為一種低成本、高安全的儲能裝置,正受到國內外廣大科研人員的關注。一種以固態含Mg2+的化合物為電解質的鎂電池的總反應如下。下列說法錯誤的是
xMg+V2O5 ![]() MgxV2O5
MgxV2O5
A. 充電時,陽極質量減小
B. 充電時,陰極反應式:Mg2++2e-=Mg
C. 放電時,正極反應式為:V2O5+xMg2++2xe-=MgxV2O5
D. 放電時,電路中每流過2mol電子,固體電解質中有2molMg2+遷移至正極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A. 氨分子是三角錐形,而甲烷是正四面體形,是因為NH3分子中有一對未成鍵的孤電子對,它對成鍵電子的排斥作用較強
B. 雜化軌道全部參加形成化學鍵
C. PCl5分子中P原子和Cl原子最外層都滿足8電子結構
D. 在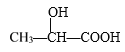 分子中含有2個手性C原子
分子中含有2個手性C原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Q、R、X、Y、Z為周期表中原子序數依次遞增的前四周期元素。
已知:①Q為元素周期表中原子半徑最小的元素;②R的基態原子中電子占據三種能量不同的能級,且每種能級中的電子總數相同;③Y的基態原子的核外成對的電子數是未成對的電子數的3倍;④Z基態原子有六個未成對電子。用對應的元素符號或化學式回答下列問題:
(1)R、X、Y的第一電離能由大到小的順序為____________________。
(2)Q元素在元素周期表中屬于____區,與Y元素同族的第四周期元素的價電子排布式為______。
(3)RY2的電子式為________________,Z3+的離子結構示意圖為____________。
(4) 由Y、Z兩種元素組成的Z2Y72-離子在酸性條件下可與乙醇反應,生成乙酸、Z3+等物質。該反應的離子方程式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為電解飽和食鹽水的實驗裝置。據此,下列敘述不正確的是 ( )
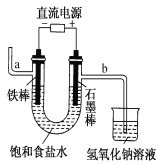
A.裝置中a管能產生氫氣
B.b管導出的是能使濕潤的淀粉碘化鉀試紙變藍的氣體
C.在石墨棒電極區域有NaOH生成
D.以電解飽和食鹽水為基礎制取氯氣等產品的工業稱為“氯堿工業”
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com