
【題目】25℃時,幾種弱酸的電離平衡常數如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
電離平衡常數 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三種酸中酸性最弱的是__________(填化學式)。
(2)CH3COOH的電離平衡常數表達式為K=__________。
(3)寫出H2CO3的第二步電離方程式:_____________。
(4)寫出H2SO3溶液和CH3COONa溶液反應的離子方程式:____________________。
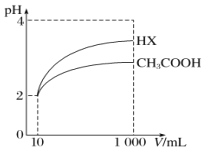
(5)將體積均為10mL、pH均為2的醋酸溶液與一元酸HX分別加水稀釋至1000mL,稀釋過程中pH的變化如圖所示,則HX的電離平衡常數____________(填“大于”“小于”或“等于”)醋酸的電離平衡常數,理由是__________________。
【答案】 H2CO3 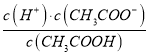 HCO3-
HCO3-![]() CO32-+H+ H2SO3+CH3COO-=HSO3-+CH3COOH 大于 pH值相同的醋酸溶液和HX溶液稀釋相同的倍數時,HX的pH變化程度更大,則HX酸性更強,電離平衡常數更大
CO32-+H+ H2SO3+CH3COO-=HSO3-+CH3COOH 大于 pH值相同的醋酸溶液和HX溶液稀釋相同的倍數時,HX的pH變化程度更大,則HX酸性更強,電離平衡常數更大
【解析】本題考查電離平衡常數、電離方程式的書寫,(1)電離平衡常數越大,說明電離程度越大,三種酸酸性強弱的順序是H2SO3>CH3COOH>H2CO3;(2)CH3COOH的電離:CH3COOH![]() CH3COO-+H+,依據電離平衡常數的表達式,即Ka=
CH3COO-+H+,依據電離平衡常數的表達式,即Ka=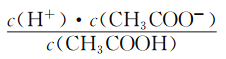 ;(3)碳酸是多元弱酸,其電離應是分步電離,電離方程式為H2CO3
;(3)碳酸是多元弱酸,其電離應是分步電離,電離方程式為H2CO3![]() H++HCO3-、HCO3-
H++HCO3-、HCO3-![]() H++CO32-或是H2CO3+H2O
H++CO32-或是H2CO3+H2O![]() H3O++HCO3-、HCO3-+H2O
H3O++HCO3-、HCO3-+H2O![]() H3O++CO32-,碳酸的第二步電離為:HCO3-
H3O++CO32-,碳酸的第二步電離為:HCO3-![]() H++CO32-或HCO3-+H2O
H++CO32-或HCO3-+H2O![]() H3O++CO32-;(4)根據上述表格數據,電離H+大小順序是H2SO3>CH3COOH>HSO3-,利用電離平衡常數大的制備電離平衡常數小的,因此H2SO3和CH3COONa發生的離子反應是:H2SO3+CH3COO-=HSO3-+CH3COOH;(5)相同pH的兩種酸,稀釋相同倍數,酸性強的pH變化大,根據圖像,稀釋相同倍數,HX的pH變化大,因此HX的酸性強于CH3COOH。
H3O++CO32-;(4)根據上述表格數據,電離H+大小順序是H2SO3>CH3COOH>HSO3-,利用電離平衡常數大的制備電離平衡常數小的,因此H2SO3和CH3COONa發生的離子反應是:H2SO3+CH3COO-=HSO3-+CH3COOH;(5)相同pH的兩種酸,稀釋相同倍數,酸性強的pH變化大,根據圖像,稀釋相同倍數,HX的pH變化大,因此HX的酸性強于CH3COOH。


科目:高中化學 來源: 題型:
【題目】.在一定溫度和壓強下,2體積X2(g)跟3體積Y2(g)化合生成2體積化合物M(g),則化合物M的化學式是( )
A.XY3B.X2Y3C.X3YD.XY
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,硫氫化鉀溶液里存在下列平衡:a.HS-+H2O![]() OH-+H2S b.HS-
OH-+H2S b.HS-![]() H++S2-
H++S2-
(1)平衡a是__________平衡;平衡b是________平衡。(填“電離”或“水解”)
(2)向KHS溶液中加入氫氧化鈉固體時,c(S2-)將________(填“增大”“ 減小”或“不變”,下同);向KHS溶被中通入HCl時,c(HS-)將______________。
(3)向KHS溶液中加入硫酸銅溶被時,有黑色沉淀(CuS)產生,則平衡a_________(填“正向” “逆向”或“不”,下同)移動,平衡b___________移動。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙分別是甲烷、乙烯、苯中的一種;①甲能使溴水褪色,甲分子中所有原子共平面。②乙既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色。③丙既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色,但在一定條件下可與液溴發生取代反應。一定條件下,1 mol丙可以和3 mol H2完全加成。
(1)甲基的電子式為____________,丙的結構簡式為____________。
(2)丙與液溴在催化劑作用下發生取代反應的化學方程式是____________________;其有機產物中所有原子是否共平面_______(填“是”或“否”)。
(3)丙與H2發生的反應類型是_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】同分異構現象是造成有機物種類繁多的重要原因之一。下列各組物質互為同分異構體的是
A. 甲烷與丙烷 B. CH2=CH2與CH3CH3
C. 纖維素與淀粉 D. CH3CH2OH與CH3OCH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z、W、Q在元素周期表中的相對位置如圖所示。下列說法正確的是( )

A. 原子半徑的大小順序為:rX>rY>rZ>rW>rQ
B. 離子Y2-和Z 3+的核外電子數和電子層數都不相同
C. 元素W與Q的最高價氧化物對應的水化物的酸性W的強
D. 元素X與元素Z的最高正化合價之和的數值等于8
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用鐵礦石、焦炭、空氣、石灰石為原料來冶煉鐵。
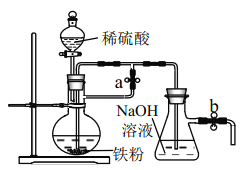
(1)請寫出用磁鐵礦在高溫下冶煉鐵的化學方程式___________。請你用化學方法設計實驗方案檢驗上述反應得到的固體產物中含有鐵粉___________。
(2)小明同學將用冶煉所得的鐵粉按下圖裝置來制備 Fe(OH)2,實驗開始時應先_______活塞a,___________活塞 b(填“打開”或“關閉”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com