
【題目】寫出下列轉化的化學方程式,注明反應類型。
(1)甲苯→TNT ___________________
(2)乙烯→聚乙烯__________________
(3)1,3—丁二烯與氯氣1,4—加成__________________
(4)溴乙烷和氫氧化鈉的乙醇溶液共熱___________________
(5)乙醇在銅催化下和氧氣反應__________________
【答案】![]() +3HO-NO2
+3HO-NO2![]()
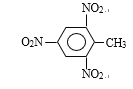 +3H2O,取代反應 nCH2=CH2
+3H2O,取代反應 nCH2=CH2![]()
![]() ,加聚反應 CH2=CH-CH=CH2+Cl2
,加聚反應 CH2=CH-CH=CH2+Cl2![]() CH2ClCH=CHCH2Cl,加成反應 CH3CH2Br+NaOH
CH2ClCH=CHCH2Cl,加成反應 CH3CH2Br+NaOH![]() CH2=CH2↑+NaBr+H2O,消去反應 2CH3CH2OH+O2
CH2=CH2↑+NaBr+H2O,消去反應 2CH3CH2OH+O2![]() 2CH3CHO+2H2O;氧化反應
2CH3CHO+2H2O;氧化反應
【解析】
(1)由于甲基的影響,使得苯環鄰位和對位上的氫原子變得活潑,容易被取代,即甲苯→TNT的反應方程式為![]() +3HO-NO2
+3HO-NO2![]()
 +3H2O,該反應為取代反應;
+3H2O,該反應為取代反應;
(2)乙烯→聚乙烯發生加聚反應,其反應方程式為nCH2=CH2![]()
![]() ;
;
(3)1,3-丁二烯與Cl2發生1,4-加成,該反應為加成反應,即反應方程式為CH2=CH-CH=CH2+Cl2![]() CH2ClCH=CHCH2Cl;
CH2ClCH=CHCH2Cl;
(4)溴乙烷在氫氧化鈉的乙醇溶液中發生消去反應,即反應方程式為CH3CH2Br+NaOH![]() CH2=CH2↑+NaBr+H2O;
CH2=CH2↑+NaBr+H2O;
(5)乙醇發生催化氧化反應,該反應為氧化反應,其反應方程式為2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;


 通城學典默寫能手系列答案
通城學典默寫能手系列答案 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】室溫條件下,用0.100 mol/L的NaOH溶液分別滴定酸HX、HY、HZ,三種酸的體積均為20.00 mL,濃度均為0.100 mol/L,滴定曲線如圖所示。下列敘述正確的是
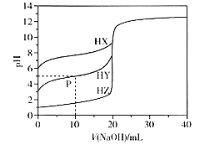
A.電離常數Ka(HX)的數量級為10-12
B.P點對應的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
C.pH=7時,三種溶液中c(X-) =c(Y-)=c(Z-)
D.HX的電離程度大于X-的水解程度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.節日里燃放的五彩繽紛的煙花是某些金屬元素化學性質的展現
B.用坩堝鉗夾住一小塊用砂紙仔細打磨過的鋁箔在酒精燈上加熱,熔化后的液態鋁滴落下來, 說明金屬鋁的熔點較低
C.將等物質的量的氧化鈉和過氧化鈉分別投入到足量且等質量的水中,得到溶質質量分數分別是 a%和 b%的兩種溶液,則a 和 b 的關系是 a=b
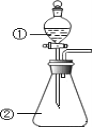
D.用如圖裝置進行實驗,將裝置①中的 AlCl3 溶液滴入裝置②濃氫氧化鈉溶液,開始滴加時就可觀察到有白色沉淀產生
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫化銨與氯化銨的結構相似,又知NH4H與水反應有H2生成,下列敘述中錯誤的是( )
A.NH4H是離子化合物
B.NH4H溶于水所形成的溶液顯酸性
C.NH4H與水反應時,NH4H是還原劑
D.NH4H固體投入少量的水中,有兩種氣體產生
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】綠色化學又稱環境友好化學,它的主要特點之一是提高原子的利用率,使原料中所有的原子全部轉化到產品中,實現“零排放”。下列反應符合綠色化學這一特點的是( )
A.工業冶煉Fe2O3 + 3CO![]() 2Fe + 3CO2
2Fe + 3CO2
B.實驗室制取二氧化碳CaCO3+2HCl=CaCl2+H2O+CO2↑
C.用生石灰制熟石灰CaO+H2O=Ca(OH)2
D.實驗室制取氫氣Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知: X(g)+2Y(g) ![]() 3Z(g) ΔH=-a kJ·molˉ1(a>0)。下列說法正確的是
3Z(g) ΔH=-a kJ·molˉ1(a>0)。下列說法正確的是
A. 達到化學平衡狀態時,Y 的正反應速率和 Z 的逆反應速率相等
B. 達到化學平衡狀態時,X、Y、Z 的濃度之比為 1 : 2 : 3
C. 達到化學平衡狀態時,反應放出的總熱量一定小于 a kJ
D. 0.2 mol X 和 0.2 mol Y 充分反應生成 Z 的物質的量一定小于 0.3 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質中含氧原子的物質的量一定相同的是
A. 3.36L O2 和 0.3 mol H2O
B. 0.1 mol H2SO4 和 3.6 g H2O
C. 0.1 mol FeSO4·7H2O 和 0.1 mol C12H22O11(蔗糖)
D. 6.02×1023 個 CO2 與 0.1 mol KMnO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室中所用少量氯氣是用下列方法制取的,MnO2+4HCl(濃) ![]() MnCl2+Cl2↑+2H2O,試回答下列問題:
MnCl2+Cl2↑+2H2O,試回答下列問題:
(1)該反應是氧化還原反應嗎?__________(填“是”或“否”),如果是氧化還原反應,請指出__________是氧化劑,______________是還原劑,____________是氧化產物,______________是還原產物,根據上述氧化還原反應判斷氧化性:__________>__________;還原性:__________>____________。
(2)寫出該反應的離子方程式______________________________。
(3)用雙線橋法標出該反應電子轉移的方向和數目__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】液相催化還原法去除水體中![]() 是一項很有前景的技術。某科研小組研究該方法中使用的固體催化劑Pd-Cu/TiO2的制備和催化條件,結果如下。
是一項很有前景的技術。某科研小組研究該方法中使用的固體催化劑Pd-Cu/TiO2的制備和催化條件,結果如下。
Ⅰ.制備Pd-Cu/TiO2的反應過程如下圖所示,光照使TiO2發生電荷分離,將金屬Pd沉積在TiO2表面。再用類似方法沉積Cu,得到在TiO2納米顆粒表面緊密接觸的Pd-Cu納米簇。
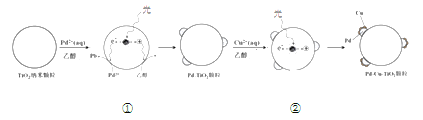
(1)該過程中,乙醇發生__________(填“氧化”或“還原”)反應。
(2)請在②中補全光照條件下形成Pd-Cu納米簇的反應過程示意圖_______。
Ⅱ.Pd-Cu/TiO2分步催化還原機理如圖a所示。其他條件相同,不同pH時,反應1小時后![]() 轉化率和不同產物在總還原產物中所占的物質的量的百分比如圖b所示。
轉化率和不同產物在總還原產物中所占的物質的量的百分比如圖b所示。
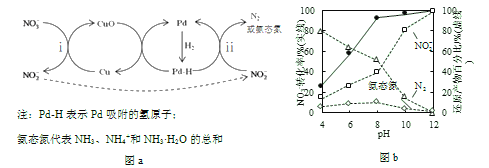
(3)該液相催化還原法中所用的還原劑是__________。
(4)i的離子方程式是__________。
(5)研究表明,OH–在Pd表面與![]() 競爭吸附,會降低Pd吸附
競爭吸附,會降低Pd吸附![]() 的能力,但對Pd吸附H的能力影響不大。
的能力,但對Pd吸附H的能力影響不大。
①隨pH增大,N2和氨態氮在還原產物中的百分比均減小,原因是____________,導致反應ⅱ的化學反應速率降低。
②隨pH減小,還原產物中![]() 的變化趨勢是__________,說明Pd表面吸附的
的變化趨勢是__________,說明Pd表面吸附的![]() 和H的個數比變大,對反應__________(用離子方程式表示)更有利。
和H的個數比變大,對反應__________(用離子方程式表示)更有利。
(7)使用Pd-Cu/TiO2,通過調節溶液pH,可將![]() 盡可能多地轉化為N2,具體方法是__________。
盡可能多地轉化為N2,具體方法是__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com