
【題目】某研究性學習小組設計實驗探究元素周期律,如圖所示。
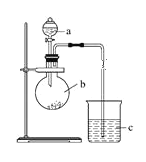
(1)儀器a的名稱是____________,加入的藥品為稀硝酸;儀器b的名稱是____________,加入的藥品為碳酸鈉固體;b中反應現象為___________,驗證氮的非金屬性比碳的___(填“強”或“弱”)。
(2)c中裝有硅酸鈉溶液,c中反應現象為____,驗證硅的非金屬性比碳的___(填“強”或“弱”)。
(3)結論:同一周期從左到右元素非金屬性逐漸____(填“增強”或“減弱”);同一主族從上到下元素非金屬性逐漸_______(填“增強”或“減弱”)。
(4)某同學考慮到稀硝酸的揮發,則應在裝置b和c之間增加一個盛有_______試劑的洗氣瓶。
【答案】分液漏斗 圓底燒瓶 固體溶解 有氣泡生成 強 產生白色渾濁弱 增強 減弱 飽和NaHCO3溶液
【解析】
非金屬性越強最高價氧化物對應的水化物酸性越強,強酸可以和弱酸鹽反應生成相應的弱酸和強酸鹽。
(1)根據a的結構特點可知其為分液漏斗;b為圓底燒瓶;硝酸的酸性比碳酸強,所以稀硝酸可以和碳酸鈉固體反應生成碳酸,碳酸不穩定分解生成二氧化碳,所以現象為:固體溶解,有氣泡生成;說明N的非金屬性比C的強;
(2)碳酸酸性比硅酸強,所以二氧化碳進入硅酸鈉溶液反應生成硅酸,硅酸不溶于水,所以現象為產生白色渾濁,可驗證硅的非金屬性比碳弱;
(3)N和C屬同一周期,N比C靠右,非金屬性N>C,說明同一周期從左到右元素非金屬性逐漸增強;Si和C屬于同一主族,且C比Si靠上,非金屬性C>Si,說明同一主族從上到下元素非金屬性逐漸減弱;
(4)硝酸的揮發性會影響實驗的準確性,除去二氧化碳氣體中混有硝酸可以用飽和碳酸氫鈉溶液。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數值。下列有關敘述正確的是( )
A. 14 g乙烯和丙烯混合氣體中的氫原子數為2NA
B. 1 mol N2與4 mol H2反應生成的NH3分子數為2NA
C. 1 mol Fe溶于過量硝酸,電子轉移數為2NA
D. 標準狀況下,2.24 L CCl4含有的共價鍵數為0.4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有五種元素,其中A、B、C為短周期主族元素,F、G為第四周期元素,它們的原子序數依次增大。請根據下列相關信息,回答問題。
A元素的核外電子數和電子層數相等 |
B元素原子的核外p電子數比s電子數少1 |
C原子第一至第四電離能如下: I1=738 kJ·mol-1,I2=1451 kJ·mol-1,I3=7733 kJ·mol-1,I4=10540 kJ·mol-1 |
F是前四周期中電負性最小的元素 |
G在周期表的第八列 |
(1)已知BA5為離子化合物,寫出其電子式:________。
(2)B元素基態原子中能量最高的電子,其電子云在空間有______個方向,原子軌道呈____形。
(3)某同學根據上述信息,推斷C基態原子的核外電子排布圖為![]() ,該同學所畫的電子排布圖違背了___________________________________。
,該同學所畫的電子排布圖違背了___________________________________。
(4)G位于第____族____區,該元素的核外電子排布式為_____________________。該二價離子很容易被氧化成三價離子,從原子軌道理論解釋原因________________________
(5)檢驗F元素的方法是___,請用原子結構的知識解釋產生此現象的原因: ______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】B的產量可以用來衡量一個國家的石油化工發展水平。A、B、C、D、E之間能進行如圖所示的反應。
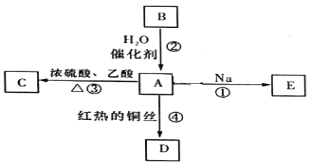
(1)A的官能團的名稱________________,B的電子式為________________。
(2)寫出①發生的化學反應方程式______________________。
(3)寫出反應④的化學反應方程式______________________。
(4)下列關于化合物B的說法正確的是_____________(填字母)。
A.B分子中所有原子都在同一平面上
B.相同物質的量的B和甲烷完全燃燒消耗氧氣的量相同
C.B可以與Cl2發生加成反應
D.B使溴的四氯化碳溶液和酸性高錳酸鉀溶液褪色的原理相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烴的結構簡式為 CH2=CH-C≡C![]() ,下列有關其幾何結構的說法正確的是( )
,下列有關其幾何結構的說法正確的是( )
A. 所有碳原子不可能在同一平面上 B. 有4個碳原子在同一直線上
C. 有5個碳原子在同一直線上 D. 有6個碳原子在同一直線上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列解釋實驗事實的離子方程式正確的是
A. 用醋酸檢驗牙膏中的摩擦劑碳酸鈣:CaCO3+2H+=Ca2++H2O+CO2↑
B. 漂白粉溶液中通入過量的SO2:ClO-+SO2+H2O=HClO+HSO3-
C. 酸性KI淀粉溶液久置后變藍:4I-+O2+4H+=2I2+2H2O
D. Na2S溶液使酚酞試液變紅:S2-+2H2O![]() 2OH-+H2S
2OH-+H2S
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A~G是短周期主族元素,原子序數依次增大。它們的部分信息如下表所示:
A | B | C | D | E | F | G | |
原子半徑/nm | 0.077 | 0.074 | 0.186 | 0.143 | 0.099 | ||
主要化合價 | -4,+4 | -2 | +3 | -4,+4 | -1,+7 | ||
其它 | 陽離子核外無電子 | 它的化合物數量眾多分布極廣 | 焰色反應呈黃色 | 無機非金屬材料的主角 |
(1)F在元素周期表中的位置是____________;
(2)任寫一個BA4的同系物的分子式___________;
(3)請用電子式表示DG的形成過程____________;
(4)元素D與C按原子個數比1∶1形成的化合物所含的化學鍵有______(填化學鍵類型);
(5)D與E相比,金屬性較強的是_____(用元素符號表示),元素D、E最高價的氧化物對應的水化物反應的離子方程式為___________
(6)工業上冶煉單質E的化學方程式為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
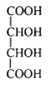
【題目】[物質結構與性質](1)酒石酸鈦配合物廣泛應用于藥物合成。酒石酸(結構如圖所示)中羧基氧原子的軌道雜化類型分別是______________
(2)氰酸(HOCN)的結構式是_________,根據等電子體原理,可推測氰酸根離子的空間構型是____。
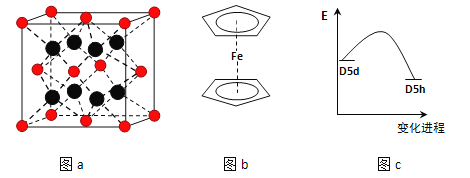
(3)FeBr2為只含有離子鍵的離子化合物,其晶胞結構如圖a,距一個Fe2+離子最近的所有Br-離子為頂點構成的幾何體為_____________.
(4)二茂鐵是最重要的金屬茂基配合物,也是最早被發現的夾心配合物,包含兩個環戊二烯基與鐵原子成鍵.二茂鐵的結構為一個鐵原子處在兩個平行的環戊二烯基環的之間,結構如圖b所示,已知二茂鐵的一氯代物只有一種.
①二茂鐵的分子式為__________.
②穆斯堡爾譜學數據顯示,二茂鐵中心鐵原子的氧化態為+2,每個茂環帶有一個單位負電荷.因此每個環含有________個π電子.
③二茂鐵中兩個茂環可以是重疊的(D5h),也可以是錯位的(D5d),它們之間的能壘僅有8~20kJ/mol.溫度升高時則繞垂直軸相對轉動,使得兩種結構可以相互轉換,轉換過程中能量變化如圖c.比較穩定的是__________結構(填“重疊”或“錯位”).
(5)氧化鎳(NiO)是一種納米材料,比表面積S(m2/g)是評價納米材料的重要參數之一(納米粒子按球形計)。基態Ni2+有_________個未成對電子,已知氧化鎳的密度為ρg/cm3;其納米粒子的直徑為Dnm列式表示其比表面積 ____________m2/g。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com