
【題目】按下圖要求完成實驗,并回答問題:
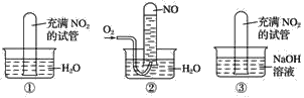
(1)實驗①將充滿二氧化氮的試管倒立水中,觀察到的現象是__________________________。
(2)實驗②將充滿二氧化氮的試管倒立水中,再通入氧氣時觀察到的現象是_________。
(3)實驗③將充滿二氧化氮的試管倒立氫氧化鈉溶液中,觀察到的現象是_______________。
【答案】氣體顏色慢慢變為無色,水面不斷上升,最后靜止在距試管底部約1/3處 水面不斷上升,最后試管內無色氣體約為原二氧化氮體積的1/3,通入適量氧氣后液面繼續上升,最后試管全部充滿液體 液面不斷上升,最后試管全部充滿液體
【解析】
(1)實驗①將充滿二氧化氮的試管倒立水中,發生如下反應3NO2+H2O==2HNO3+NO,由反應我們可判斷氣體的顏色變化和試管內液面高度的變化。
(2)實驗②將充滿二氧化氮的試管倒立水中,發生如下反應3NO2+H2O==2HNO3+NO;再通入氧氣,發生如下反應4NO+3O2+2H2O=4HNO3,從反應中可得出氣體顏色、溶液體積發生的變化。
(3)實驗③將充滿二氧化氮的試管倒立氫氧化鈉溶液中,發生的反應為2NO2+2NaOH=NaNO3+NaNO2+H2O,從反應的分析中,可得出能觀察到的現象。
(1)實驗①將充滿二氧化氮的試管倒立水中,發生如下反應3NO2+H2O==2HNO3+NO,由反應可得出觀察到的現象是氣體顏色慢慢變為無色,水面不斷上升,最后靜止在距試管底部約1/3處。答案為:氣體顏色慢慢變為無色,水面不斷上升,最后靜止在距試管底部約1/3處;
(2)實驗②將充滿二氧化氮的試管倒立水中,發生如下反應3NO2+H2O==2HNO3+NO;再通入氧氣,發生如下反應4NO+3O2+2H2O=4HNO3,由此得出可觀察到的現象是:水面不斷上升,最后試管內無色氣體約為原二氧化氮體積的1/3,通入適量氧氣后液面繼續上升,最后試管全部充滿液體。答案為:水面不斷上升,最后試管內無色氣體約為原二氧化氮體積的1/3,通入適量氧氣后液面繼續上升,最后試管全部充滿液體;
(3)實驗③將充滿二氧化氮的試管倒立氫氧化鈉溶液中,發生的反應為2NO2+2NaOH=NaNO3+NaNO2+H2O,觀察到的現象是液面不斷上升,最后試管全部充滿液體。答案為:液面不斷上升,最后試管全部充滿液體。


 同步奧數系列答案
同步奧數系列答案科目:高中化學 來源: 題型:
【題目】鹽酸是中學化學常用的試劑,以下兩個實驗均和鹽酸有關。
I.用密度為1.25 g·mL-1,質量分數36.5%的濃鹽酸配制500 mL 0.20 mol·L-1鹽酸溶液,請回答下列問題:
(1)濃鹽酸的物質的量濃度為____________。
(2)配制500 mL 0.20 mol·L-1鹽酸需要用量筒量取上述濃鹽酸_______mL。
(3)對配制的鹽酸測定,發現物質的量濃度小于0.2 mol·L-1,引起該誤差的操作___(填序號)
A.容量瓶用蒸餾水洗滌后未干燥,含有少量蒸餾水
B.用量筒量取濃鹽酸時,仰視刻度線量取濃鹽酸
C.定容時,仰視容量瓶刻度線進行定容
D.定容后,把容量瓶倒置搖勻后發現液面低于刻度線,又滴加水至刻度處
Ⅱ.某學生設計如下圖所示的實驗裝置,利用濃鹽酸與高錳酸鉀反應產生的氯氣與熟石灰反應制取少量漂白粉,并探究氯、溴、碘的相關性質。請回答下列問題:

(4)A裝置名稱為________。
(5)漂白粉將在C裝置的U形管中產生,寫出生成漂白粉的化學方程式_______________。
(6)E裝置中裝有KI與CCl4混合液,向D中緩緩通入一定量氯氣后,打開D裝置中活塞,將D中少量溶液滴加入E裝置中,振蕩,觀察到下層呈紫紅色,由此得出結論:Br2置換出了I2,有同學對該結論提出異議,可能的理由是__________________________。
(7)F裝置的作用是_____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國化工專家侯德榜的“侯氏制堿法”曾為世界制堿工業做出了突出貢獻。他以NaCl、NH3、CO2等為原料先制得NaHCO3,進而生產出純堿。有關反應的化學方程式為:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
回答下列問題:
(1)碳酸氫銨與飽和食鹽水反應,能析出碳酸氫鈉晶體的原因是___(填字母標號)。
a.碳酸氫鈉難溶于水
b.碳酸氫鈉受熱易分解
c.碳酸氫鈉的溶解度相對較小,所以在溶液中首先結晶析出
(2)某探究活動小組根據上述制堿原理,進行碳酸氫鈉的制備實驗,同學們按各自設計的方案實驗。
①一位同學將二氧化碳氣體通入含氨的飽和食鹽水中制備碳酸氫鈉,實驗裝置如圖所示(圖中夾持、固定用的儀器未畫出)。
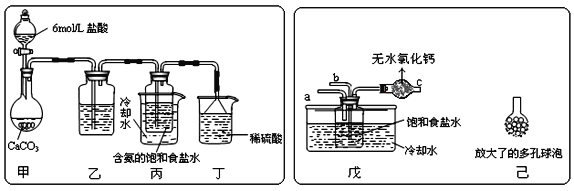
試回答下列有關問題:
(Ⅰ)乙裝置中的試劑是___;
(Ⅱ)丁裝置中稀硫酸的作用是___;
(Ⅲ)實驗結束后,分離出NaHCO3晶體的操作是___(填分離操作的名稱)。
②另一位同學用圖中戊裝置(其它裝置未畫出)進行實驗。
(Ⅰ)實驗時,須先從___管通入___氣體,再從___管中通入___氣體;
(Ⅱ)有同學建議在戊裝置的b管下端連接己裝置,理由是___;
(3)請你再寫出一種實驗室制取少量碳酸氫鈉的方法:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】低溫脫硝技術可用于處理廢氣中的氮氧化物,發生的化學反應為:
2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O
2N2(g)+3H2O![]()
在恒容的密閉容器中,下列有關說法正確的是
A. 平衡時,其他條件不變,升高溫度可使該反應的平衡常數增大
B. 平衡時,其他條件不變,增加NH3的濃度,廢氣中氮氧化物的轉化率減小
C. 單位時間內消耗NO和N2的物質的量比為1:2時,反應達到平衡
D. 其他條件不變,使用高效催化劑,廢氣中氮氧化物的轉化率增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】9.5 g含雜質的MgCl2溶于水,加足量的AgNO3溶液,得到28 g沉淀。若只含有一種雜質,則雜質不可能是( )
A.NaCl
B.AlCl3
C.CaCl2
D.FeCl3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】噴泉實驗是中學化學的重要實驗。
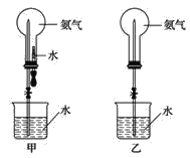
(1)實驗室中常用圖甲裝置進行NH3的噴泉實驗。用該裝置完成噴泉實驗的操作方法是_________。
(2)若用圖乙裝置進行NH3的噴泉實驗,打開止水夾后,燒杯中的液體不能進入燒瓶。請寫出引發噴泉實驗的一種操作方法:____________。
(3)若將圖甲裝置中膠頭滴管和燒杯中液體改為NaOH溶液,能用改動后的甲裝置進行噴泉實驗的一組氣體是_________(填字母)。
A.HCl和CO2 B.Cl2和CO C.O2和SO2 D.NO2和NO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅是重要的工業原材料,現有銅、氧化亞銅組成的混合物,某研究性學習小組為了探究其組成情況,取35.2 g混合物加入0.5 L 3.4 mol·L-1的稀硝酸,固體物質完全反應,生成一氧化氮4.48 L(標準狀況)。向所得溶液中加入aL 2.0 mol·L-1氫氧化鈉溶液,恰好使溶液中的銅離子沉淀完全。
(1)氧化亞銅與稀硝酸反應的化學方程式為_______________。
(2)混合物中,銅的物質的量為____________;氧化亞銅的物質的量為______________。
(3)所加氫氧化鈉溶液的體積是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學幫助水質檢測站配制480 mL 0.5 mol·L-1NaOH溶液以備使用。
(1)該同學用到的玻璃儀器除了燒杯、量筒、試劑瓶,還需要_________________。
(2)其操作步驟如下圖所示,則如圖操作應在下圖中的_______(填選項字母)之間。
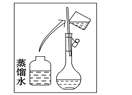
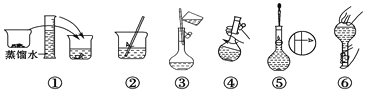
A.②與③ B.①與② C.④與⑤
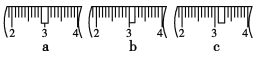
(3)該同學應稱取NaOH固體________g,用質量為23.1 g的燒杯放在托盤天平上稱取所需NaOH固體時,請在附表中選取所需的砝碼大小__________(填字母)
a | b | c | d | e | |
砝碼大小/g | 100 | 50 | 20 | 10 | 5 |
并在下圖中選出能正確表示游碼位置的選項________(填字母)。
(4)下列操作對所配溶液的濃度大小有何影響?
① 轉移完溶液后未洗滌玻璃棒和燒杯,濃度會_______(填“偏大”、“偏小”或“無影響”,下同)。
② 容量瓶中原來有少量蒸餾水,濃度會__________。
③ 以480mL溶液體積計算所需NaOH的質量_________。
④ 未冷卻到室溫就注入容量瓶定容_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com