
【題目】黃銅礦(CuFeS2)是煉銅的最主要礦物。火法冶煉黃銅礦的過程中,其中一步反應是;2Cu2O+ Cu2S![]() 6Cu+SO2。回答下列問題。
6Cu+SO2。回答下列問題。
(1)Cu+的價電子軌道表示式為__________________;Cu2O與Cu2S比較,熔點較高的是_______,原因為_____________________________________。
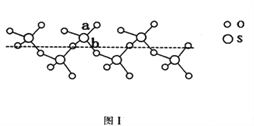
(2)SO2與SO3的鍵角相比,鍵角更大的是____________。將純液態SO3冷卻到289.8K時凝固得到一種螺旋狀單鏈結構的固體,其結構如下圖1所示。此固態SO3中S原子的雜化軌道類型是_______;該結構中S—O鍵長有兩類,一類鍵長約140pm,另一類鍵長約為160pm,較短的鍵為_________(填圖中字母)。
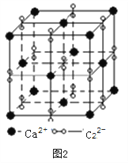
(3)離子化合物CaC2的一種晶體結構如下圖2所示。寫出該物質的電子式_____。從鈣離子看,屬于____________堆積;一個晶胞含有的π鍵平均有______個。

(4)奧氏體是碳溶解在γ—Fe中形成的一種間隙固溶體,無磁性,其晶胞如上圖3所示,則該物質的化學式為________,若晶體密度為dg/cm3,則晶胞中最近的兩個碳原子的距離為____________________ pm。(阿伏加德羅常數的值用NA表示,寫出計算式即可)。
【答案】 ![]() Cu2O 兩物質均為離子化合物,且離子所帶電荷數相同,O2-半徑小于S2-,所以Cu2O的晶格能大,熔點更高 SO3 sp3 a
Cu2O 兩物質均為離子化合物,且離子所帶電荷數相同,O2-半徑小于S2-,所以Cu2O的晶格能大,熔點更高 SO3 sp3 a ![]() 面心立方 8 FeC
面心立方 8 FeC ![]()
【解析】(1)本題考查軌道式的表示、晶體熔沸點高低判斷,Cu位于第四周期IB族,Cu+的價電子為第三層的d能級,根據泡利原理和洪特規則,Cu+價電子軌道式為![]() ;Cu2O和Cu2S都屬于離子晶體,晶格能越大,晶體熔沸點越高,晶格能與半徑、所帶電荷數有關,半徑越小、所帶電荷數越多,晶格能越大,Cu2O和Cu2S所帶電荷數相同,S2-的半徑大于O2-的半徑,因此Cu2S的沸點低于Cu2O;(2)本題考查雜化類型判斷,SO2含有的孤電子對為(6-2×2)/2=1,SO3中含有孤電子對為(6-2×3)/2=0,孤電子對之間的斥力>孤電子對-成鍵電子對之間的斥力>成鍵電子對之間斥力,因此SO3鍵角大于SO2鍵角,根據圖1,S有4個σ鍵,無孤電子對,價層電子對數為4,雜化軌道數等于價層電子對數,即雜化類型為sp3;如圖所示,a含有雙鍵的成分,鍵能較大,鍵長較短,另一類為配位鍵,為單鍵,鍵能較小,鍵長較長,即較短的鍵為a;(3)本題考查晶胞,根據圖2,CaC2的電子式為:
;Cu2O和Cu2S都屬于離子晶體,晶格能越大,晶體熔沸點越高,晶格能與半徑、所帶電荷數有關,半徑越小、所帶電荷數越多,晶格能越大,Cu2O和Cu2S所帶電荷數相同,S2-的半徑大于O2-的半徑,因此Cu2S的沸點低于Cu2O;(2)本題考查雜化類型判斷,SO2含有的孤電子對為(6-2×2)/2=1,SO3中含有孤電子對為(6-2×3)/2=0,孤電子對之間的斥力>孤電子對-成鍵電子對之間的斥力>成鍵電子對之間斥力,因此SO3鍵角大于SO2鍵角,根據圖1,S有4個σ鍵,無孤電子對,價層電子對數為4,雜化軌道數等于價層電子對數,即雜化類型為sp3;如圖所示,a含有雙鍵的成分,鍵能較大,鍵長較短,另一類為配位鍵,為單鍵,鍵能較小,鍵長較長,即較短的鍵為a;(3)本題考查晶胞,根據圖2,CaC2的電子式為:![]() ;根據晶胞的結構,Ca2+位于頂點和面心,因此屬于面心立方堆積;C22-位于棱上和體心,屬于晶胞的C22-的個數為12×1/4+1=4,根據CaC2的電子式,兩個碳原子之間有3對電子對,即1個C22-有2個π鍵,即1個晶胞中有2×4=8個π鍵;(4)本題考查晶胞知識,根據圖3,鐵原子位于頂點、面心,個數為8×1/8+6×1/2=4,碳原子位于棱上和體心,個數為12×1/4+1=4,因此化學式為FeC,晶胞的質量為4×68/NAg,根據密度的定義,得出晶胞的邊長為
;根據晶胞的結構,Ca2+位于頂點和面心,因此屬于面心立方堆積;C22-位于棱上和體心,屬于晶胞的C22-的個數為12×1/4+1=4,根據CaC2的電子式,兩個碳原子之間有3對電子對,即1個C22-有2個π鍵,即1個晶胞中有2×4=8個π鍵;(4)本題考查晶胞知識,根據圖3,鐵原子位于頂點、面心,個數為8×1/8+6×1/2=4,碳原子位于棱上和體心,個數為12×1/4+1=4,因此化學式為FeC,晶胞的質量為4×68/NAg,根據密度的定義,得出晶胞的邊長為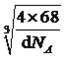 cm,根據晶胞的結構,兩個最近的碳原子的距離是面對角線的一半,則兩個最近的碳原子的距離是
cm,根據晶胞的結構,兩個最近的碳原子的距離是面對角線的一半,則兩個最近的碳原子的距離是![]() pm。
pm。


 周周清檢測系列答案
周周清檢測系列答案 輕巧奪冠周測月考直通高考系列答案
輕巧奪冠周測月考直通高考系列答案科目:高中化學 來源: 題型:
【題目】下列關于2008年北京奧運會所用材料中,屬于有機合成材料的是( )
A.用羊絨作外層材料制作吉祥物——“福娃”
B.用輕薄高品質鋁合金制作奧運會火炬——“祥云”
C.用合金高強度鋼材鑄造國家體育場——“鳥巢”
D.用ETFE膜(聚四氟乙烯一乙烯共聚物)建造國家游泳中心——“水立方”
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有三組溶液:①汽油和氯化鈉溶液 ②碘的CCl4溶液 ③氯化鈉和單質溴的水溶液,分離以上各混合液的正確方法依次是
A. 萃取、蒸發、分液 B. 分液、蒸餾、萃取
C. 分液、萃取、蒸餾 D. 蒸餾、萃取、分液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲~辛等元素在周期表中的相對位置如下表.甲與戊的原子序數相差3,戊的一種單質是自然界硬度最大的物質,丁與辛屬同周期元素,下列判斷正確的是( ) 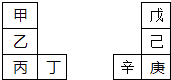
A.金屬性:甲>乙>丁
B.原子半徑:辛>戊>甲
C.丙與庚的元素原子核外電子數相差13
D.形成的最簡單氫化物的穩定性:己>戊
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據報道,我國在南海北部神狐海域進行的可燃冰(甲烷的水合物)試采獲得成功。甲烷是一種重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,有以下三種:
部分氧化:CH4(g)+ ![]() O2(g)
O2(g)![]() CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
水蒸氣重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH4 ④
2CO(g)+2H2(g) ΔH4 ④
則反應②自發進行的條件是________________,ΔH4 =_____________kJ·mol-1。
(2)起始向密閉容器中充入一定量的CH4(g)和O2(g),發生反應①。CH4(g)的平衡轉化率與溫度(T)和壓強(P)的關系如圖所示。
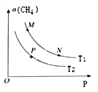
①N、P兩點的平衡常數:K(N)_______K(P)(填“>”“<”或“=”),理由是_________。
②M、N兩點的H2的物質的量濃度c(M)______c(N)(填“>”“<”或“=”)。
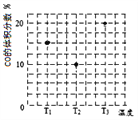
(3)合成氣CO和H2在一定條件下能發生如下反應:CO(g) +2H2(g)![]() CH3OH(g)。在容積均為V L的甲、乙、丙三個密閉容器中分別充入amol CO和2a mol H2,三個容器的反應溫度分別為T1、T2、T3且恒定不變,在其他條件相同的情況下,實驗測得反應均進行到t min時CO的體積分數如圖所示,此時三個容器中一定處在化學平衡狀態的是_________(填“T1”或“T2” 或“T3”);該溫度下的化學平衡常數為___________(用a、V表示)。
CH3OH(g)。在容積均為V L的甲、乙、丙三個密閉容器中分別充入amol CO和2a mol H2,三個容器的反應溫度分別為T1、T2、T3且恒定不變,在其他條件相同的情況下,實驗測得反應均進行到t min時CO的體積分數如圖所示,此時三個容器中一定處在化學平衡狀態的是_________(填“T1”或“T2” 或“T3”);該溫度下的化學平衡常數為___________(用a、V表示)。
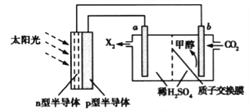
(4)光能儲存一般是指將光能轉換為電能或化學能進行儲存,利用太陽光、CO2、H2O生成甲醇的光能儲存裝置如圖所示,制備開始時質子交換膜兩側的溶液質量相等。則b極的電極反應式為___________________;當電路中有3mol電子轉移時,質子交換膜兩側溶液相差_________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗發現,298 K時,在FeCl3酸性溶液中加少量鋅粒后,Fe3+立即被還原成Fe2+。某夏令營興趣小組根據該實驗事實設計了如圖所示原電池裝置。下列有關說法正確的是( )

A. 該原電池的正極反應是Zn-2e-==Zn2+
B. 該電池總反應為3Zn+2Fe3+==2Fe+3Zn2+
C. 該電池鉑電極上有氣泡出現
D. 左燒杯中溶液的血紅色逐漸褪去
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】FeCl3在現代工業生產應用廣泛。某化學研究性學習小組模擬工業流程制備無水FeCl3,再用副產品FeCl3溶液吸收有毒的H2S。
Ⅰ.經查閱資料得知:無水FeCl3在空氣中易潮解,加熱易升華。他們設計了制備無水FeCl3的實驗方案,裝置示意圖(加熱及夾持裝置略去)及操作步驟如下:
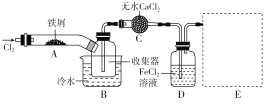
①檢驗裝置的氣密性; ②通入干燥的Cl2,趕盡裝置中的空氣;
③用酒精燈在鐵屑下方加熱至反應完成; ④……
⑤體系冷卻后,停止通入Cl2,并用干燥的N2趕盡Cl2,將收集器密封。
請回答下列問題:
(1)裝置A中反應的化學方程式為____________________________________________。
(2)在③步加熱后,生成的煙狀FeCl3大部分進入收集器,少量沉積在反應管A右端。要使沉積的FeCl3進入收集器,第④步操作是________。
(3)操作步驟中,為防止FeCl3潮解而采取的措施有(填步驟序號)________。
(4)裝置B中冷水浴的作用為________;裝置C的名稱為________;裝置D中FeCl2全部反應后,因失去吸收Cl2的作用而失效,寫出檢驗FeCl2是否失效的試劑____________。通常保存FeCl2溶液時要加入_______以防止被氧化,有關反應的離子方程式為________。
(5)在虛線框中畫出尾氣吸收裝置E并注明試劑________。
Ⅱ.該組同學用裝置D中的副產品FeCl3溶液吸收H2S,得到單質硫;過濾后,再以石墨為電極,在一定條件下電解濾液。
(6)FeCl3與H2S反應的離子方程式為__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A和B是同周期的相鄰元素,B和C是同主族的相鄰元素,且A,B,C最外層電子數之和為19,則A,B,C三種元素按照順序是( )
A.N,F,Cl
B.F,O,S
C.S,Cl、O
D.S,O,F
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com