
【題目】請按如圖所示要求,完成下列實驗:
實驗①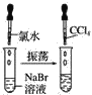
實驗②
實驗③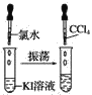
(1)實驗①靜置后,觀察到實驗現象是__,反應的化學方程式是__。
(2)實驗②靜置后,觀察到實驗現象是__,反應的化學方程式是__。
(3)實驗③靜置后,觀察到實驗現象是__,反應的化學方程式是__。
(4)通過上述實驗可知,鹵素單質氧化性由強到弱的順序是__,鹵素陰離子的還原性由強到弱的順序是__。
【答案】液體分層,上層無色,下層橙紅色 2NaBr+Cl2=2NaCl+Br2 液體分層,上層無色,下層紫紅色 2KI+Br2=2KBr+I2 液體分層,上層無色,下層紫紅色 2KI+Cl2=2KCl+I2 Cl2>Br2>I2 Cl-<Br-<I-
【解析】
(1)實驗①中氯氣能氧化NaBr生成NaCl和Br2;
(2)實驗②中Br2能氧化KI生成KBr和I2;
(3)實驗③中氯氣能氧化KI生成KCl和I2;
(4)自發的氧化還原反應中氧化劑的氧化性大于氧化產物,還原劑的還原性大于還原產物。
(1)實驗①中氯氣能氧化NaBr生成NaCl和Br2,發生反應的化學方程式是2NaBr+Cl2=2NaCl+Br2,則可觀察到實驗現象是液體分層,上層無色,下層橙紅色;
(2)實驗②中Br2能氧化KI生成KBr和I2,發生反應的化學方程式是2KI+Br2=2KBr+I2,則觀察到實驗現象是液體分層,上層無色,下層紫紅色;
(3)實驗③中氯氣能氧化KI生成KCl和I2,發生反應的化學方程式是2KI+Cl2=2KCl+I2,則觀察到實驗現象是液體分層,上層無色,下層紫紅色;
(4)由2NaBr+Cl2=2NaCl+Br2可知氧化性:Cl2>Br2,還原性:Br->Cl-;由2KI+Br2=2KBr+I2可知氧化性:Br2 >I2,還原性:I->Br-;由2KI+Cl2=2KCl+I2可知氧化性:Cl2>I2,還原性:I->Cl-;則鹵素單質氧化性由強到弱的順序是Cl2>Br2>I2,鹵素陰離子的還原性由強到弱的順序是Cl-<Br-<I-。


 狀元坊全程突破導練測系列答案
狀元坊全程突破導練測系列答案科目:高中化學 來源: 題型:
【題目】下列有關實驗說法,不正確的是( )
A.苯酚不慎沾到皮膚上,應立即用酒精洗滌,再用大量水沖洗
B.排除堿式滴定管尖嘴的氣泡時,應擠壓玻璃球,使液體快速流出,向下沖出氣泡
C.可用新制的![]() 懸濁液檢驗牙膏中存在的甘油
懸濁液檢驗牙膏中存在的甘油
D.利用硝酸銀、稀硝酸可鑒別![]() 和
和![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家研發了一種室溫下“可呼吸”的Na-CO2二次電池。將NaClO4溶于有機溶劑作為電解液,鈉和負載碳納米管的鎳網分別作為電極材料,電池的總反應為:![]() ,下列說法錯誤的是( )
,下列說法錯誤的是( )
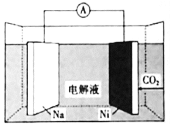
A.放電時,Na為電池的負極
B.充電時釋放CO2,放電時吸收CO2
C.放電時,正極反應為:![]()
D.充電時,陽極釋放6.72L CO2時,轉移的電子數為0.4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制取氯氣,將多余的氯氣用100 mL 1.7mol/L的NaOH溶液完全吸收。對吸收后的溶液進行分析化驗,測知c(OH-)=0.1mol/L (不考慮反應前后溶液的體積變化) 。ClO-和ClO3-的物質的量濃度之比為5∶1。請回答:
(1)吸收氯氣消耗的NaOH的物質的量為_______________mol。
(2)被氧化的氯氣的物質的量為_______________mol,被還原的氯氣的物質的量為 _______________mol。
(3)若采用二氧化錳和濃鹽酸共熱的方法制氯氣,制備尾氣中的氯氣所消耗的二氧化錳的質量為_______________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2014年5月7日,天津某工程檢測公司在進行探傷作業期間,一枚黃豆粒大小的放射源銥-192丟失,造成了嚴重的安全事故,圖示是銥在元素周期表中的信息,下列說法正確的是( )
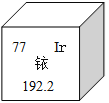
A. 銥的相對原子質量為192.2克
B. 銥原子核內的中子數為77
C. K2IrO3中Ir的化合價為+4
D. 生活中常用的銥金筆為純凈的銥單質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有氯化鈉和碘化鈉的混合物共26.7 g,溶于水,通入足量氯氣后,蒸干、灼燒,固體質量變為 17.55 g。
(1)原混合物中碘化鈉的質量是________。
(2)原混合物中氯化鈉的質量分數是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列對應的離子方程式正確的是( )
A.酸性高錳酸鉀溶液和草酸溶液反應:2![]() +16H++5
+16H++5![]() ═2Mn2++10CO2↑+8H2O
═2Mn2++10CO2↑+8H2O
B.向氯化鐵溶液中通入過量二氧化硫:2Fe3++3SO2+6H2O═2Fe+3![]() +12H+
+12H+
C.銀和稀硝酸反應:3Ag+4H++![]() ═3Ag++2H2O+NO↑
═3Ag++2H2O+NO↑
D.向氯水中加入碳酸鈉:Cl2+![]() ═Cl-+ClO-+CO2↑
═Cl-+ClO-+CO2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E五種短周期主族元素,原子序數依次增大,其中C、D、E同周期,A、C同主族,B、E同主族,B元素的原子最外層電子數是次外層電子數的三倍,又知A單質是密度最小的氣體。
請回答下列問題:
(1)元素C在周期表中的位置______________________________。
(2)A、C、E以原子個數比1∶1∶1形成化合物X,其電子式為_________________。
(3)B、E對應簡單氫化物穩定性的大小順序是(用分子式表示) ________________。
(4)若D是非金屬元素,其單質在電子工業中有重要應用,請寫出其氧化物溶于強堿溶液的離子方程式:___________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】新型鎂鋁合金(Mg17Al12)有儲氫性能,它一定條件下完全吸氫的反應為Mg17Al12+17H2═17MgH2+12Al,得到的混合物Y(17MgH2+12Al)能與酸反應釋放出大量氫氣.下列說法正確的是
A. 該合金應在氮氣保護下,將一定比例的Mg、Al單質熔煉而成
B. 合金在吸氫過程中被H2還原
C. 一定量的鎂鋁合金既可以完全溶于足量鹽酸中,也可以完全溶于足量的NaOH溶液中
D. 等質量的鎂、鋁、和鎂鋁合金分別與足量的鹽酸反應生成H2的體積(同溫同壓下)由大到小的順序為:V(Mg)> V(合金)>V(鋁)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com