
(14分)A、B、C、D、E、F是六種短周期主族元素,它們的原子序數依次增大,其中C、F分別是同一主族元素,A、F兩種元素的原子核中質子數之和比C、D兩種元素原子核中質子數之和少2,F元素的最外層電子數是次外層電子數的0.75倍。又知B元素的最外層電子數是內層電子數的2倍,E元素的最外層電子數等于其電子層數。請回答:
(1)1 mol由E、F二種元素組成的化合物跟由A、C、D三種元素組成的化合物反應生成兩種鹽和水,完全反應后消耗后者的物質的量為 。
(2)A、C、F間可以形成甲、乙兩種負一價雙原子陰離子,甲有18個電子,乙有10個電子,則甲與乙反應的離子方程式為 ;
(3)科學研究證明:化學反應熱只與始終態有關,與過程無關。單質B的燃燒熱為a kJ/mol。由B、C二種元素組成的化合物BC 14g完全燃燒放出熱量b kJ,寫出單質B和單質C反應生成BC的熱化學方程式: ;
(4)工業上在高溫的條件下,可以用A2C與BC反應制取單質A2。在等體積的I、II兩個密閉容器中分別充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定條件下,充分反應后分別達到平衡(兩容器溫度相等)。下列說法正確的是。
A.達到平衡所需要的時間:I>II B.達到平衡后A2C的轉化率:I=II
C.達到平衡后BC的物質的量:I>II D.達到平衡后A2的體積分數:I<II
(5)用B元素的單質與E元素的單質可以制成電極浸入由A、C、D三種元素組成化合物的溶液中構成電池,則電池負極反應式為 。
(1)8 mol(3分)
(2) HS-+OH-=S2-+H2O(2分)
(3) C(s)+ 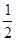 O2(g)=CO(g);△H= -(a-2b) kJ/mol(3分)
O2(g)=CO(g);△H= -(a-2b) kJ/mol(3分)
(4)A、B (4分)(5)2Al+8OH- -6e-=2AlO2-+4H2O(2分)
【解析】B元素的最外層電子數是內層電子數的2倍,只有C元素,即B是C。F元素的最外層電子數是次外層電子數的0.75倍,而在短周期元素中次外層電子數一般是2或8,所以F元素的最外層電子數是6,即為S元素。C、F分別是同一主族元素,則C是O元素。
E元素的最外層電子數等于其電子層數,由于E的原子序數對應O的,所以E是第三周期元素,即為鋁元素。A、F兩種元素的原子核中質子數之和比C、D兩種元素原子核中質子數之和少2,由于A、F兩種元素的原子核中質子數之和至少是17,所以D一定位于第三周期,即D可能是Na也可能是Mg,若D是鈉,則A是氫元素。若D是鎂,則A是He,不符合題意。
(1)E、F二種元素組成的化合物跟由A、C、D三種元素組成的化合物反應的方程式為Al2S3+8NaOH=2NaAlO2+3Na2S+4H2O。
(2)A、C、F間可以形成甲、乙兩種負一價雙原子陰離子,其中甲有18個電子,乙有10個電子,所以分別為HS-和OH-,方程式為 HS-+OH-=S2-+H2O。
(3)考查蓋斯定律的應用。由題意知①C(s)+O2(g)=CO2(g) △H=-a kJ/mol,②CO(g)+1/2O2(g)=CO2(g) △H=-2b kJ/mol。
①-②得C(s)+
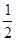 O2(g)=CO(g);△H= -(a-2b) kJ/mol
O2(g)=CO(g);△H= -(a-2b) kJ/mol
(4)A2C與BC反應制取單質A2的方程式為CO+H2O(g) CO2+H2。因為反應前后體積不變,所以兩容器中的化學平衡是等效的,各種物質的含量相同,但物質的濃度不同。其中后者的濃度均是前者的2倍。在Ⅱ容器中壓強大,反應快到達平衡的時間短。
CO2+H2。因為反應前后體積不變,所以兩容器中的化學平衡是等效的,各種物質的含量相同,但物質的濃度不同。其中后者的濃度均是前者的2倍。在Ⅱ容器中壓強大,反應快到達平衡的時間短。
(5)碳電極和鋁電極導線連接后插入氫氧化鈉溶液中,鋁是負極,電極反應式為2Al+8OH- -6e-=2AlO2-+4H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:閱讀理解
| 氟化物 | X | Y | Z |
| 熔點/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 [化學/選修/物質結構與性質]A、B、C、D、E五種短周期元素,原子序數依次增大,各元素對應的單質均為固體.A、C、E三元素的原子核外均只有2個未成對電子.B、E元素的原子序數之和等于C、D元素的原子序數之和.
[化學/選修/物質結構與性質]A、B、C、D、E五種短周期元素,原子序數依次增大,各元素對應的單質均為固體.A、C、E三元素的原子核外均只有2個未成對電子.B、E元素的原子序數之和等于C、D元素的原子序數之和.查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com