
【題目】白藜蘆醇是一種抗腫瘤的藥物,合成它的一種路線如圖:
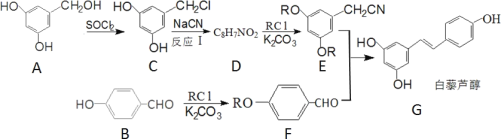
回答下列問題:
(1)B 的化學名稱是_______;G 中含有的官能團名稱是_________。
(2)反應I的反應類型為____________。
(3)D 的結構簡式是______________。
(4)B的芳香類同分異構體中可以發生水解的結構簡式為_____________;該有機物在 NaOH溶液作用下完全水解的化學反應方程式為______________。
(5)據已有知識并結合相關信息,寫出以 ![]() 和 CH3OH 為原料制備
和 CH3OH 為原料制備 ![]() 的合成路線流程圖______________(無機試劑任用)。 (已知 RCN
的合成路線流程圖______________(無機試劑任用)。 (已知 RCN![]() RCOOH)合成路線流程圖如下: (甲
RCOOH)合成路線流程圖如下: (甲![]() 乙……
乙……![]() 目標產物)
目標產物)
【答案】對羥基苯甲醛(4-羥基苯甲醛) 羥基、碳碳雙鍵 取代反應 
 +2NaOH→HCOONa+
+2NaOH→HCOONa+ +H2O
+H2O ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
有機物A(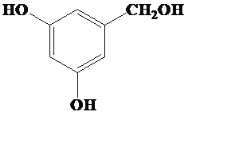 )經SOCl2反應生成C(
)經SOCl2反應生成C( ),有機物C經過NaCN反應生成D,D經過RCl和K2CO3反應生成E(
),有機物C經過NaCN反應生成D,D經過RCl和K2CO3反應生成E(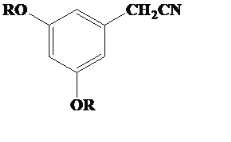 );有機物B經過RCl和K2CO3反應生成F(
);有機物B經過RCl和K2CO3反應生成F( ),根據這個反應和D的分子式可以推出,D為
),根據這個反應和D的分子式可以推出,D為 ,據此分析。
,據此分析。
(1)有機物B的名稱為對羥基苯甲醛(4-羥基苯甲醛);G中含有的官能團為羥基、碳碳雙鍵;
(2)反應Ⅰ為 和NaCN的反應,反應方程式為
和NaCN的反應,反應方程式為 +NaCN→
+NaCN→ +NaCl,反應中氯原子被-CN取代,故反應類型為取代反應;
+NaCl,反應中氯原子被-CN取代,故反應類型為取代反應;
(3)根據分析,D的結構簡式為 ;
;
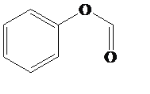
(4)B的芳香族同分異構體中能發生水解的是酯,結構簡式為 ,該有機物可以與NaOH發生反應生成苯酚鈉和甲酸鈉,該有機物與NaOH完全反應的方程式為
,該有機物可以與NaOH發生反應生成苯酚鈉和甲酸鈉,該有機物與NaOH完全反應的方程式為 +2NaOH→HCOONa+
+2NaOH→HCOONa+ +H2O ;
+H2O ;
(5)根據已知條件,可將![]() 與SOCl2發生反應生成
與SOCl2發生反應生成![]() ,再與NaCN反應生成
,再與NaCN反應生成![]() ,將CNCH2CH2CH2CH2CN經酸性條件水解生成
,將CNCH2CH2CH2CH2CN經酸性條件水解生成![]() ,經得到的酸與甲醇反應生成目標產物,合成路線為
,經得到的酸與甲醇反應生成目標產物,合成路線為![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在有關限定條件下溶液中一定能大量共存的是( )
A. 由水電離產生的c(H+)=10-12mol/L的溶液中:K+、Na+、ClO-、I-
B. c(H+)=![]() mol/L的溶液中:K+、Fe3+、Cl-、CO32—
mol/L的溶液中:K+、Fe3+、Cl-、CO32—
C. 常溫下,![]() =1×10-12的溶液:K+、AlO2—、CO32—、Na+
=1×10-12的溶液:K+、AlO2—、CO32—、Na+
D. pH=13的溶液中:AlO2—、Cl-、HCO3—、SO42—
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關物質的轉化關系如下圖所示。A為一種黃綠色的氣體,B為常見的無色液體,H為一種助燃的氣體,F為一種氣體,它在A中燃燒產生蒼白色火焰,E為一種能被磁鐵吸引的金屬。
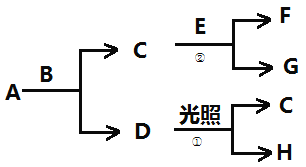
(1)B的化學式為____________。
(2)F的化學式為____________。
(3)寫出反應②的化學方程式:_______________________________。
(4)寫出反應①的化學方程式:_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某溫度時,將 n mol·L-1氨水滴入 10 mL 1.0 mol·L-1鹽酸中,溶液 pH 和溫度隨加入氨水體積變化曲線如圖所示。下列有關說法錯誤的是
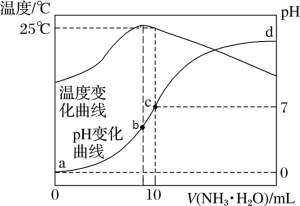
A.c 點存在守恒關系:c(NH4+)=c(Cl-)
B.b 點:c(Cl-)> c(NH4+)>c(H+)>c(OH-)
C.水的電離程度:b > c > a > d
D.25℃時 ,NH4Cl 水解平衡常數為(n-1)×10-7(用 n 表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】足量銅與一定量濃硝酸反應,得到硝酸銅溶液和NO2、N2O4、NO的混合氣體,這些氣體與3.36LO2(標準狀況)混合后通入水中,所有氣體完全被水吸收生成硝酸。若向所得硝酸銅溶液中加入5mol·L-1NaOH溶液至 Cu2+恰好完全沉淀,則消耗NaOH溶液的體積是( )
A.60mLB.120mLC.240mLD.360mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用 NA 表示阿伏加德羅常數的值,下列判斷正確的是( )
A.標準狀況下,22.4 L CCl4 含有的碳原子數是 NA
B.56 g Fe 與足量稀鹽酸反應轉移的電子數為 3 NA
C.0.1 mol/L Na2SO4 溶液含有的鈉離子數為 0.2 NA
D.常溫常壓下,2g H2 中含有的分子數為 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知2KClO3 + H2C2O4 + H2SO4= K2SO4 + 2ClO2 + 2CO2 + 2H2O。
(1)用單線橋法表示該反應的電子轉移的方向和數目_______。
(2)該反應的氧化劑是____,還原劑是_____,氧化產物是_____,還原產物是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式正確的是( )
A.鐵與鹽酸反應:2Fe+6H+==2 Fe3++ H2↑
B.在氯化鋁溶液中滴加過量的氨水:Al3++4 OH﹣═ AlO![]() +2 H2O
+2 H2O
C.向氯化鐵溶液中加入鐵粉:Fe3++Fe=2Fe2+
D.氯化鐵溶液與氫氧化鈉溶液反應:Fe3++3OH﹣═ Fe(OH)3↓
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解質水溶液中存在電離平衡、水解平衡、溶解平衡,請回答下列問題。
(1)已知部分弱酸的電離常數如表:
弱酸 | CH3COOH | HCN | H2CO3 |
電離常數(25℃) | Ka= 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7Ka2=5.6×l0-11 |
①0.1moI/LNaCN溶液和0.1mol/LNaHCO3溶液中,c(CN-)___c(HCO3-)(填“>”、“<”或“=”)。
②常溫下,物質的量濃度相同的三種溶液:A.CH3COONa B.NaCN C.Na2CO3,其pH由大到小的順序是___(填編號)。
③將少量CO2通入NaCN溶液,反應的離子方程式是_____。
④室溫下,-定濃度的CH3COONa溶液pH=9,用離子方程式表示溶液呈堿性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH)=____。
(2)某溫度下,pH=3的鹽酸中[OH-]=10-9mol/L。該溫度下, pH=2的H2SO4與pH=11的NaOH混合后pH變為9,則硫酸與氫氧化鈉的體積比為____。
(3)室溫下,用0.100mol/L鹽酸溶液滴定20.00mL0.l00mol/L的某氨水溶液,滴定曲線如圖所示(橫坐標為鹽酸的體積)。
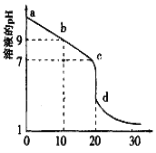
①d點所示的溶液中離子濃度由大到小的順序依次為______。
②b點所示的溶液中c(NH4+)-c(NH3·H2O)=_____(寫出準確數值)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com