
從原子、分子水平上幫助我們認識物質構成的規律;以微粒之間不同的作用力為線索,研究不同類型物質的有關性質;從物質結構決定性質的視角預測物質的有關性質.

(1)下列說法正確的是 (填字母).
A.元素電負性由大到小的順序為F>O>N
B.一個苯分子含3個π鍵和6個σ鍵
C.氯化鈉和氯化銫晶體中氯離子的配位數相同
D.第一電離能的大小為Br>Se>As
(2)根據等電子體原理,羰基硫(OCS)分子的結構式為 .光氣(COCl2)各原子最外層都滿足8電子穩定結構,COCl2分子空間構型為 (用文字描述).
(3)Cu 2+基態的電子排布式為 .向硫酸銅溶液中加入過量氨水,然后加入適量乙醇,溶液中會析出深藍色的[Cu(NH3)4]SO4晶體,該物質中配位原子的雜化方式為 ,不考慮空間構型,其內界結構可用示意圖表示為 .
(1)A ;(2)OCS 平面三角形
(3)1s22s22p63s23p63d9(或[Ar]3d9) sp3 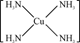
【解析】(1)A.同周期自左而右電負性增大,故電負性F>O>N,故A正確;
B.苯分子中化學鍵是介于單鍵與雙鍵之間的一種特殊化學鍵,故B錯誤;
C.氯化鈉晶體中氯離子配位數為6、氯化銫晶體中氯離子的配位數為8,故D錯誤;
D.同周期自左而右等于電離能呈增大趨勢,但As原子4p能級有3個電子,處于半滿穩定狀態,能量降低,第一電離能高于同周期相鄰元素,故第一電離能Br>As>Se,故D錯誤;
故選:A;
(2)羰基硫(OCS)與CO2為等電子體,具有CO2分子結構,故羰基硫(OCS)結構式為O=C=S,
光氣(COCl2)各原子最外層都滿足8電子穩定結構,C原子與氯原子之間形成C-Cl單鍵,C原子與O原子之間形成C=O雙鍵,光氣分子的結構式是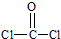 ,碳原子成3個σ鍵,雜化軌道數目為3,分子中C原子采取sp2雜化成鍵,故COCl2為平面三角形,
,碳原子成3個σ鍵,雜化軌道數目為3,分子中C原子采取sp2雜化成鍵,故COCl2為平面三角形,
故答案為:O=C=S;平面三角形;
(3)Cu是29號元素,原子核外電子數為29,基態原子核外電子排布式為:1s22s22p63s23p63d104s1,銅原子失去4s及3d上各一個電子形成Cu2+,故Cu2+離子的電子排布式為:1s22s22p63s23p63d9,
NH3分子中N原子成3個N-H鍵,含有1對孤對電子,雜化軌道數目為4,采取sp3雜化;
Cu2+提供空軌道,N原子提供孤對電子,Cu2+與NH3分子之間形成配位鍵,內界結構用示意圖表示為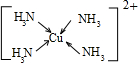 ,
,
故答案為:1s22s22p63s23p63d9;sp3;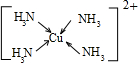
考點:元素電離能、電負性的含義及應用;晶胞的計算;原子軌道雜化方式及雜化類型判斷


 海淀黃岡名師導航系列答案
海淀黃岡名師導航系列答案 普通高中同步練習冊系列答案
普通高中同步練習冊系列答案科目:高中化學 來源: 題型:
 《物質結構與性質》
《物質結構與性質》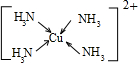

查看答案和解析>>
科目:高中化學 來源: 題型:
| A、高鐵酸鉀廣泛用于廢水的凈化處理,因為它具有強還原性 | ||||||||
B、最近合成117號元素的反應為:
| ||||||||
| C、“原子經濟”和“零排放”是綠色化學和化工的發展目標 | ||||||||
D、最近在星際介質中發現的分子蒽(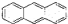 ),該分子中所有原子可以處于同一平面 ),該分子中所有原子可以處于同一平面 |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年江蘇省蘇州市高三調研測試化學試卷(解析版) 題型:填空題
從原子、分子水平上幫助我們認識物質構成的規律;以微粒之間不同的作用力為線索,研究不同類型物質的有關性質;從物質結構決定性質的視角預測物質的有關性質。

(1)下列說法正確的是 (填序號)。
A.元素電負性由大到小的順序為:F>O>N
B.一個苯分子含3個π鍵和6個σ鍵
C.氯化鈉和氯化銫晶體中氯離子的配位數相同
D.第一電離能的大小為:Br>Se>As
(2)根據等電子體原理,羰基硫(OCS)分子的結構式應為 。光氣(COC12)分子內各原子最外層都滿足8電子穩定結構,則光氣分子的空間構型為 (用文字描述)。
(3)Cu2+基態電子排布式為 。向硫酸銅溶液中加入過量氨水,然后加入適量乙醇,溶液中會析出深藍色的[Cu(NH3)4]SO4晶體,該物質中配位原子的雜化方式為 ,若不考慮空間構型,其內界結構可用示意圖表示為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com